解答题-原理综合题 较难0.4 引用3 组卷372
氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________ 。
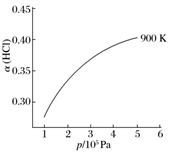
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________ 。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________ (用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO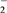 + Cl-
+ Cl-
Ⅱ.ClO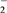 +ClO-===ClO
+ClO-===ClO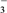 +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________ 。
(1)已知:900 K时,4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。①该反应是放热还是吸热,判断并说明理由
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5
 ×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO
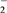 + Cl-
+ Cl-Ⅱ.ClO
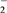 +ClO-===ClO
+ClO-===ClO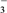 +Cl-
+Cl-常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
2017高三上·浙江·专题练习
类题推荐
I.甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: 2 CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
(2)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
① 10~30 min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
② CH3OH(g)的平衡转化率为_______ 。
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)。
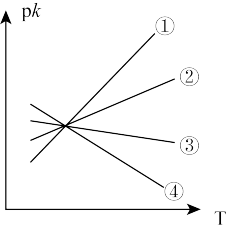
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线_______ 。
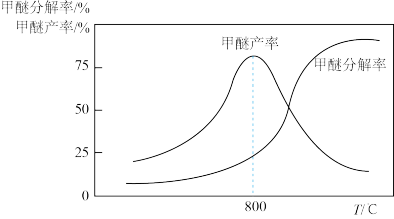
(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为_______ 。
II.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
(5)当压强从2×105增加到时5×105,平衡_______ 移动。(填“正向”、“逆向”或“不”)
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =_______ 。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 | B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
② CH3OH(g)的平衡转化率为
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.64 | 0.68 | 0.68 |
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线

(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为

II.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol/L) | 0.08 | 0.20 | 0.44 |
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网