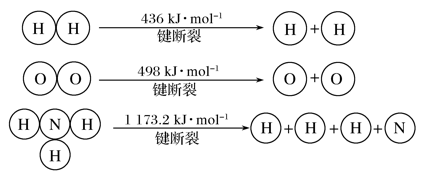
填空题 适中0.65 引用1 组卷177
根据要求回答下列问题:
(1)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和H2O,涉及的反应有:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:______________________________ 。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方程式:
______________________________________________ 。
(3)我国煤炭资源相对石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。煤的主要成分为碳氢化合物,用CH代表煤的“分子式”。已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)===2CO(g)+H2(g) ΔH1
气化后的气体合成甲醇 CO(g)+2H2(g)===CH3OH(g) ΔH2
甲醇制备丙烯的反应 3CH3OH(g)===C3H6(g)+3H2O(g) ΔH3
写出在一定条件下,煤炭在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式:
______________________________________ 。
(1)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和H2O,涉及的反应有:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
| CO2的量 | NaOH的量 | 放出的热量 |
| 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
| 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方程式:
(3)我国煤炭资源相对石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。煤的主要成分为碳氢化合物,用CH代表煤的“分子式”。已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)===2CO(g)+H2(g) ΔH1
气化后的气体合成甲醇 CO(g)+2H2(g)===CH3OH(g) ΔH2
甲醇制备丙烯的反应 3CH3OH(g)===C3H6(g)+3H2O(g) ΔH3
写出在一定条件下,煤炭在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式:
2017高二·吉林延边·专题练习
类题推荐
根据要求回答下列问题:
(1)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
①在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____ (填“>”“<”或“=”)890.3 kJ。
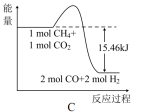
②甲烷与CO2可用于合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是_______ (填字母)。



(2)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热ΔH=_____________ 。
(3)一定条件下,不同量的CO2与不同量的NaOH溶液充分反应放出的热量如表所示:
写出该条件下,CO2(g)与NaOH溶液反应生成NaHCO3的热化学方程式:___________________ 。
(1)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
①在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活。甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量
②甲烷与CO2可用于合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是




(2)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热ΔH=
(3)一定条件下,不同量的CO2与不同量的NaOH溶液充分反应放出的热量如表所示:
| CO2(g)的量 | NaOH的量 | 放出的热量 |
| 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
| 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下,CO2(g)与NaOH溶液反应生成NaHCO3的热化学方程式:
I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)⇌Y(g)+Z(g)相关数据如下表所示:
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________ 。容器A和容器B中起始时X的反应速率v(X)A___________ v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________ 387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________ ,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________ 。
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________

A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)⇌Y(g)+Z(g)相关数据如下表所示:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| X(g) | Y(g) | Z(g) | ||
| A | 387 | 0.20 | 0.080 | 0.080 |
| B | 387 | 0.40 | 0.160 | 0.160 |
| C | T | 0.20 | 0.090 | 0.090 |
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=
(2)已知该正反应为放热反应,则T
(3)容器B中X的平衡转化率为
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是

A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网