解答题-工业流程题 较难0.4 引用1 组卷188
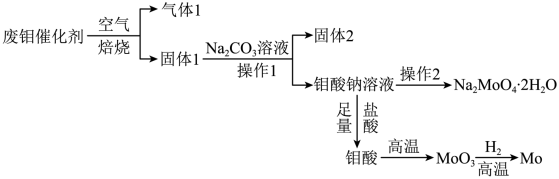
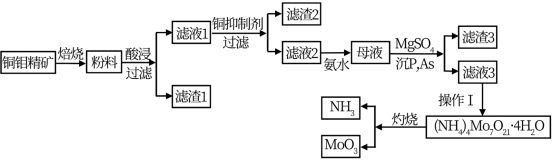
钼是一种稀有金属,为人体及动植物必须的微量元素,纯金属钼和钼合金具有强度大、耐高温、耐磨损、耐腐蚀等多种有点,广泛应用于冶金、机械、化工、军工、电光源、润滑剂、航空航天等领域。某化学兴趣小组在实验室模拟了从铜钼精矿(主要含有Cu2S、MoS2,SiO2,P,As等)中提取分离得到氧化钼的过程:
已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为_________________________ 。
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为___________________________________ ,
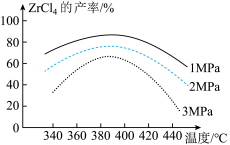
焙烧过程中应控制在800-870K左右,其原因为____________________________ 。
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式_______________________________ ;
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式_____ ;
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-7mol/L时可认为沉淀完全,则欲处理IL滤液需要0.1mol/L的Na4[Fe(CN)6]体积为_________ (体积变化忽略不计,保留两位小数)。
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24• 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为_______ 。

已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为
焙烧过程中应控制在800-870K左右,其原因为
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-7mol/L时可认为沉淀完全,则欲处理IL滤液需要0.1mol/L的Na4[Fe(CN)6]体积为
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24• 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为
2017·河北石家庄·三模
类题推荐
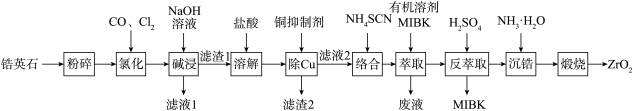
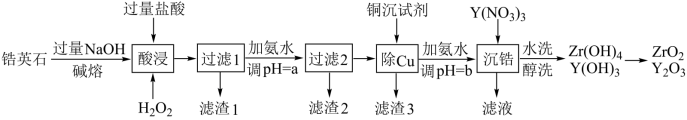
二氧化锆(ZrO2)是重要的耐高温材料,氧化钇(Y2O3)掺杂的二氧化锆(ZrO2)对O2-有良好的传导性。天然锆英石(ZrSiO4)含有FeO、Al2O3、CuO、SiO2等杂质,工业以锆英石为原料制备ZrO2(掺杂Y2O3)的工艺流程如图:
已知:
①锆英石常温下与酸、碱不反应,高温时能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:
结合上面信息回答:
(1)ZrSiO4中Zr的化合价为_______ 。滤渣1的主要成分为_______ 。
(2)碱熔过程生成Na2ZrO3的方程式:_______ 。
(3)“酸浸”过程中所加的H2O2可用_______ 代替。该过程中生成ZrO2+的离子方程式为:_______ 。
(4)经过滤2的滤液中铜离子的浓度范围:_______ (Ksp[Cu(OH)2]=2.2×10-20),常用的沉铜试剂为氰化钠,NaCN可与重金属阳离子反应,生成溶度积较小的沉淀如Cu(CN)2,Ksp[Cu(CN)2]=4.0×10-10,已知该溶液中Cu2+的浓度为5.00×10-3 mol/L,若需要溶液中Cu2+浓度等于1.00×10-6mol/L,则预处理10L该溶液需要0.100mol/L NaCN溶液的体积为_______ (忽略溶液混合后体积变化,结果保留3位有效数字)。
(5)由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_______ 。
(6)醇洗的目的:_______ 。
(7)氧化锆氧量分析仪主要用于测量燃烧过程中烟气的含氧浓度,其工作原理如图所示。在固体电解质ZrO2(加入一定量的Y2O3)的两面各烧结一个铂电极,当ZrO2两侧的氧分压不同时,氧分压高的一侧的氧以离子形式向氧分压低的一侧迁移。使用空气做参比,测出两侧的氧浓差电势,便可知道烟气中氧气含量。下列说法正确的是_______ 。
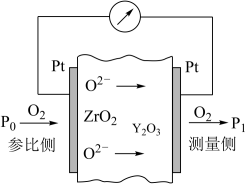
A.图中参比侧电极电势低于测量侧电极电势
B.测量侧电极反应式为O2+4e-=2O2-
C.分析仪工作时Zr4+、Y3+移向参比侧
D.测量侧处于富氧环境中,分析仪中的电流会发生逆转

已知:
①锆英石常温下与酸、碱不反应,高温时能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:
| 离子 | Fe3+ | Al3+ | Cu2+ | ZrO2+ | Fe2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 4.4 | 6.2 | 7.6 |
| 完全沉淀时pH | 3.2 | 5.2 | 6.4 | 8.0 | 9.7 |
(1)ZrSiO4中Zr的化合价为
(2)碱熔过程生成Na2ZrO3的方程式:
(3)“酸浸”过程中所加的H2O2可用
(4)经过滤2的滤液中铜离子的浓度范围:
(5)由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为
(6)醇洗的目的:
(7)氧化锆氧量分析仪主要用于测量燃烧过程中烟气的含氧浓度,其工作原理如图所示。在固体电解质ZrO2(加入一定量的Y2O3)的两面各烧结一个铂电极,当ZrO2两侧的氧分压不同时,氧分压高的一侧的氧以离子形式向氧分压低的一侧迁移。使用空气做参比,测出两侧的氧浓差电势,便可知道烟气中氧气含量。下列说法正确的是

A.图中参比侧电极电势低于测量侧电极电势
B.测量侧电极反应式为O2+4e-=2O2-
C.分析仪工作时Zr4+、Y3+移向参比侧
D.测量侧处于富氧环境中,分析仪中的电流会发生逆转
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网