解答题-原理综合题 较难0.4 引用3 组卷307
氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g) NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________ 。
(2)反应ⅰ的正反应的活化能E_____ △H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________ (填“增大”、“减少”或“无法确定”),原因为_____________________ 。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________ (填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______ 5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
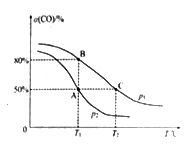
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________ ;p1和p2的大小关系为__________ 。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________ 。
已知:ⅰ.NO(g)+CO2(g)
 NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1ⅱ.2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为
(2)反应ⅰ的正反应的活化能E
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C 三点的平衡常数KA、KB、KC的大小关系为
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为
2017·河北石家庄·一模
类题推荐
在工业上,常用CO和H2合成甲醇,其相关的反应原理方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:①CO(g)+ O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
回答下列问题:
(1)△H=___________ kJ/mol 。
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。

①当起始 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)___________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________ (选填“增大”、“减小”或“不变”);
②当起始 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“D”、“E”或“F”) 。
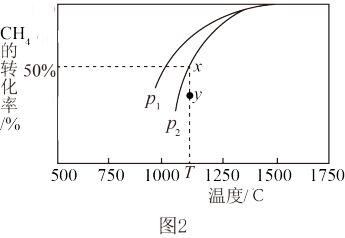
(4)已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1___________ P2(选填“>” “<” 或“=”);当压强为P2时,在y点:v(正)___________ v(逆)(选填“大于”、“小于”或“等于”)。若P2=3MPa且在恒压体系中发生,则T℃时该反应的平衡常数Kp = ___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
已知:①CO(g)+
②H2(g)+
③CH3OH(g)+
回答下列问题:
(1)△H=
(2)能说明反应CO(g)+2H2(g)
| A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |

①当起始
②当起始
(4)已知CO2(g)+CH4(g)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网