解答题-原理综合题 适中0.65 引用1 组卷180
工业常用硫铁矿煅烧生产硫酸,而硫铁矿烧渣(主要含Fe2O3)可用来炼铁。
(1)Fe2O3用CO还原培烧的过程中,反应物、生成物和温度之间的关系如图所示。
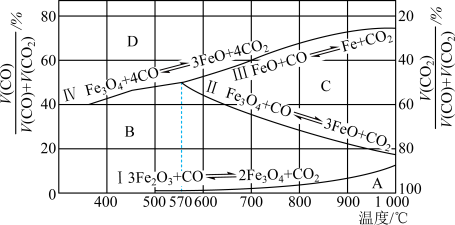
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的; A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH3=c kJ·mol-1
①反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的ΔH=________ kJ·mol-1(用含a、b、c表示)。
②800℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________ 。
③据图分析,下列说法正确的是______ (填字母)。
a.温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
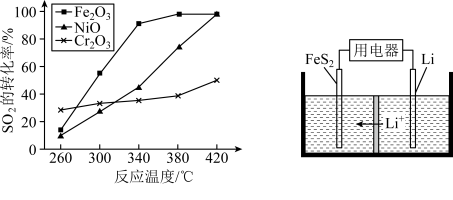
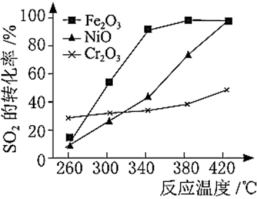
(2)①一定条件下,用Fe2O3、NiO或Cr2O3作催化剂可对燃煤烟气回收硫。反应为:2CO(g)+SO2(g) 2CO2(g)+S(l) △H=-270kJ•mol-1
2CO2(g)+S(l) △H=-270kJ•mol-1
其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:______________ 。
②从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。则5 mol FeS2发生反应,转移电子的物质的量为____ 。
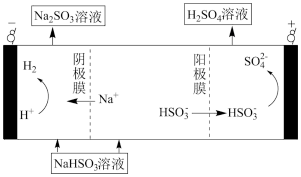
(3)FeS2是Li/ FeS2电池(如图)的正极活性物质。
①FeSO4、Na2S2O3、S及H2O在200℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式:________________ 。。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li=Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li=2Li++FeS22-,则第2步正极的电极反应式为____________ 。
(1)Fe2O3用CO还原培烧的过程中,反应物、生成物和温度之间的关系如图所示。

(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的; A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH3=c kJ·mol-1
①反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的ΔH=
②800℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为
③据图分析,下列说法正确的是
a.温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(2)①一定条件下,用Fe2O3、NiO或Cr2O3作催化剂可对燃煤烟气回收硫。反应为:2CO(g)+SO2(g)
其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是:
②从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。则5 mol FeS2发生反应,转移电子的物质的量为
(3)FeS2是Li/ FeS2电池(如图)的正极活性物质。

①FeSO4、Na2S2O3、S及H2O在200℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式:
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li=Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li=2Li++FeS22-,则第2步正极的电极反应式为
2017·江苏苏州·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

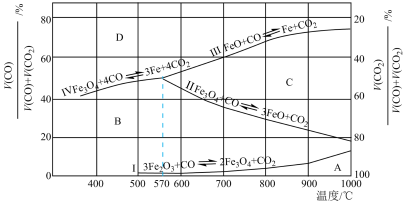 (图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)

