解答题-原理综合题 适中0.65 引用1 组卷436
氢氰酸(HCN)是一种具有苦杏仁气味的无色液体,易溶于水。回答下列问题:
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为______________ 。
②合成氢氰酸的化学方程式为________ 。
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
25 ℃时,物质的量浓度均为0.1 mol • L-1的NaCN、NaHCO3和Na2CO3三种溶液,其pH最大的是________ (填化学式)。
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=__________ (用△H1、△H2表示)。
②对于反应Ⅱ,减小压强,HCN的转化率______ (填“提高”、“不变”或“降低”)。
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=_________ 。
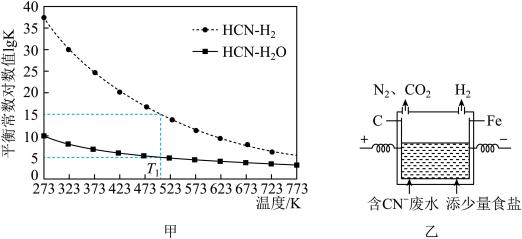
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为________________ 。
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为
②合成氢氰酸的化学方程式为
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4. 5×10-7 Ka2=4.7×10-11 |
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=
②对于反应Ⅱ,减小压强,HCN的转化率
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=

(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为
2017·福建宁德·三模
类题推荐
回答下列问题:
(1)用H2还原CO2在一定条件下合成CH3OH(不考虑副反应)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
CH3OH(g)+H2O(g) △H<0。恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出H2O。
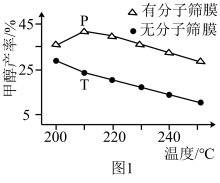
①甲醇平衡产率随温度升高而降低的原因为____ 。
②P点甲醇平衡产率高于T点的原因为____ 。
③根据如图,在此条件下采用该分子筛膜时的最佳反应温度为____ ℃。
(2)已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
①体积相同、pH相同的三种酸溶液a.HCOOHb.HCNc.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的顺序是____ (用序号表示)。
②25℃知某浓度的HCOONa溶液pH=9,原因是____ (用离子方程式表示),该溶液中由水电离出OH-的浓度为____ 。
③浓度相同的四种溶液HCOONa、NaCN、NaHCO3、Na2CO3,其碱性由强到弱的顺序是____ 。
(1)用H2还原CO2在一定条件下合成CH3OH(不考虑副反应)CO2(g)+3H2(g)

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇平衡产率高于T点的原因为
③根据如图,在此条件下采用该分子筛膜时的最佳反应温度为
(2)已知部分弱酸的电离平衡常数如表,根据表中数据回答下列问题。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
②25℃知某浓度的HCOONa溶液pH=9,原因是
③浓度相同的四种溶液HCOONa、NaCN、NaHCO3、Na2CO3,其碱性由强到弱的顺序是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网