解答题-原理综合题 较难0.4 引用1 组卷310
运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO .
.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________ (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________ (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH )
)______________ c(SO )(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO
)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO 完全沉淀,则反应后溶液的pH
完全沉淀,则反应后溶液的pH______________ 7(填“>”、”=”或“<”)。
(3)将分别含有MnO 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________ ,一定不存在的是______________ 。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为________________ mol·L−1,此时溶液中c(CrO )等于
)等于______________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO
(1)常温下,pH=5的NaHSO4溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:
(3)将分别含有MnO
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
16-17高二下·四川成都·期中
类题推荐
运用相关原理,回答下列各小题:
I.已知:硫酸氢钠在水中的电离方程式为___________________________
(1)常温下,pH=5的硫酸氢钠溶液中水的电离程度______ pH=9的一水合氨中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的硫酸氢钠与氨水混合后,溶液呈酸性的原因为______ 。(用离子方程式表示);若一定量的硫酸氢钠溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)___ 2c(SO42-)(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的PH_____ 7(填“>”、”=”或“<”)
II.25℃时,电离平衡常数:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:_______________________ ;(填编号)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中,c(CH3COO-)-c(Na+)=_____________ 。(填准确数值)
I.已知:硫酸氢钠在水中的电离方程式为
(1)常温下,pH=5的硫酸氢钠溶液中水的电离程度
(2)等体积等物质的量浓度的硫酸氢钠与氨水混合后,溶液呈酸性的原因为
II.25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中,c(CH3COO-)-c(Na+)=
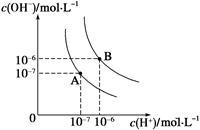
(1)水的电离平衡曲线如图所示,若A点、B点分别表示25 ℃和100 ℃时水的电离达平衡时的离子浓度。则表示25 ℃的是___________ (填“A”或“B”)。100 ℃时,在1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=__________ mol·L-1。100 ℃时,5×10-5 mol·L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为_____________ 。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
①25℃时,有等浓度的NaHCO3溶液、NaCN溶液、Na2CO3溶液、CH3COONa溶液,四种溶液的pH由大到小的顺序为_________________________ 。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)__________ c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______________________ 。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO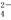 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为___________ mol·L−1,此时溶液中c(CrO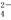 )等于
)等于__________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaHCO3溶液、NaCN溶液、Na2CO3溶液、CH3COONa溶液,四种溶液的pH由大到小的顺序为
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)
③向NaCN溶液中通入少量CO2,所发生反应的离子方程式为
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO
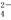 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为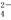 )等于
)等于组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网