填空题 较难0.4 引用1 组卷288
盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________ 。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是_______
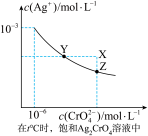
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______ 。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
(1)用离子方程式表示FeCl3可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是

A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是
16-17高二下·贵州遵义·期中
类题推荐
回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________ 。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________ 中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________ (填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________ (填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________ 。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为__________ mol·L−1,此时溶液中c(CrO42−)为_________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
| 化学式 | HCN | CH3COOH | H2CO3 |
| 电离平衡常数 | K=4.9×10−10 | K=1.8×10−5 | K1=4.4×10−7 K2=4.7×10−11 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)写出碳酸的第一步电离方程式__________________________________ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________ 。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN ),下列关系正确的是
),下列关系正确的是_______ 。
a.c(H+)>c(OH ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10 mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10 mol/L,则此溶液中由水电离产生的c(H+)=
mol/L,则此溶液中由水电离产生的c(H+)=_________ 。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ⇌Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______ 沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________ 。(Ksp(FeS)=6.3×10 ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10 )
)
| 醋酸 | 碳酸 | 氢氰酸 |
| Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN
a.c(H+)>c(OH
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ⇌Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成
NaHCO3是重要的化工原料,在Na2CO3保护氛围下可制备Mg3N2。回答下列问题。
(1)常温下,NaHCO3水溶液显碱性的原因是___________ (用离子方程式表示):将NaHCO3水溶液中c(Na+),c( )、c(
)、c( ),c(H2CO3)按从大到小的顺序排列
),c(H2CO3)按从大到小的顺序排列_________ 。
(2)泡沫灭火器的原理是Al2(SO4)3溶液和NaHCO3溶液混合,请写出该反应的离子方程式______ 。
已知Ka1(H2CO3)=4.0×10-7,Ka2(H2CO3)=8.4×10-11,NaHCO3溶液中存在自耦电离:2 =H2CO3+
=H2CO3+ ,该反应平衡常数K=
,该反应平衡常数K=________ 。
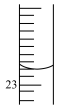
(3)可用碱式滴定管准确量取一定体积的NaHCO3溶液。如图所示滴定管读数为_____ 。
(4)酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。已知25℃时部分弱电解质的电离常数如后表:
①浓度相同的①NaCN②CH3COONa③Na2S三种溶液,其pH由大到小的顺序为________ (填序号)。
②已知次磷酸(H3PO2)是一种一元弱酸,向10mL H3PO2溶液中加入10mL筝物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:___________ ;常温下,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填序号)。
A.c(H+) B. C.
C. D.
D.
③25℃时,氨水与NH4Cl的混合溶液pH=8,该溶液中c( ):c(NH3·H2O)=
):c(NH3·H2O)=________ 。
④分析化学中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4作指示剂,利用Ag+与 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c(
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全(浓度等于1×10-5mol/L)时,溶液中c( )=
)=_____ mol/L (结果保留两位有效数字,已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10)
(1)常温下,NaHCO3水溶液显碱性的原因是
(2)泡沫灭火器的原理是Al2(SO4)3溶液和NaHCO3溶液混合,请写出该反应的离子方程式
已知Ka1(H2CO3)=4.0×10-7,Ka2(H2CO3)=8.4×10-11,NaHCO3溶液中存在自耦电离:2
(3)可用碱式滴定管准确量取一定体积的NaHCO3溶液。如图所示滴定管读数为

(4)酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。已知25℃时部分弱电解质的电离常数如后表:
| 物质 | HCN | CH3COOH | H3PO2 | H2S | NH3·H2O |
| 电离常数 | Ka=4×10-10 | Ka=1.8×10-5 | Ka=5.9×10-2 | Ka1=1×10-7 Ka2=7×10-15 | Kb=1.8×10-5 |
②已知次磷酸(H3PO2)是一种一元弱酸,向10mL H3PO2溶液中加入10mL筝物质的量浓度的NaOH溶液后,所得溶液中的阴离子有:
A.c(H+) B.
③25℃时,氨水与NH4Cl的混合溶液pH=8,该溶液中c(
④分析化学中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4作指示剂,利用Ag+与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


