填空题 适中0.65 引用1 组卷350
运用化学反应原理知识回答下列有关碳和碳的化合物的问题
⑴汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应在一定条件下可以自发进行)。在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与CO反应的化学方程式___________________ ,该反应的△S_______ 0 (填“<”或“>”)。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。根据表中数据计算K1=_________ ,根据表中数据判断,温度T1和T2关系是(填序号)______________ 。
A. T1>T2B. T1<T2C.无法比较
(2)生成的CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200mL3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为____________ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为:___________ mol/L。(忽略混合前后溶液体积的变化)
(4)已知14gCO完全燃烧时放出141.5 kJ 的热量,则写出CO燃烧热的热化学方程式:_____________ 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极:_________ ;正极:________
⑴汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应在一定条件下可以自发进行)。在2L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
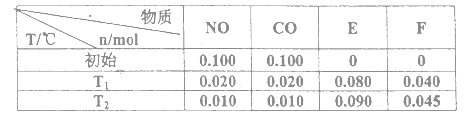
①请结合上表数据,写出NO与CO反应的化学方程式
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。根据表中数据计算K1=
A. T1>T2B. T1<T2C.无法比较
(2)生成的CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200mL3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为:
(4)已知14gCO完全燃烧时放出141.5 kJ 的热量,则写出CO燃烧热的热化学方程式:
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极:
2017·河北衡水·三模
知识点:表示燃烧热的热化学方程式书写化学平衡的有关计算化学平衡常数的概念及表达方式盐溶液中离子浓度大小的比较溶度积常数相关计算原电池电极反应式书写 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式:___________________________ 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①写出NO与活性炭反应的化学方程式 _____________________ 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 =_______ 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)________________ 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:________________________ 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为:________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为___________________ 。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式:
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
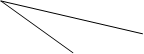 物质 物质T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 =
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为
工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:
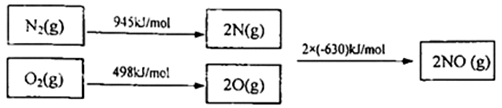
则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=_________ 。
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g) N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
①0~2 s 内用N2表示的化学反应速率为______ 该温度下,反应的平衡常数K1________ 。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1___ K2 (填“>”、“<”或“=”),原因是____________________ 。
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
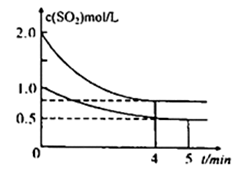
下列说法正确的是_________ (填标号)。
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。
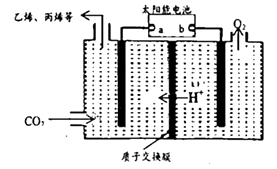
①该工艺中能量转化方式主要有___________________ 。
②电解时,生成乙烯的电极反应式是__________________________ 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(1)已知甲烷的燃烧热为890kJ/mol;1mol 水蒸气变成液态水放热44k;N2与O2反应生成NO 的过程如下:

则CH4(g) +4NO(g)=2N2 (g) +CO2(g) +2H2O(g)△H=
(2)汽车尾气中含有CO 和NO,某研究小组利用反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:
N2(g)+2CO2(g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO 和NO,能自发进行上述反应,测得不同时间的NO和CO 的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1
(3)向甲、乙两个容积均为1L 的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2molSO2、1molO2,乙充入1molSO2 、0.5molO2),发生反应:2SO2(g)+O2(g)
 2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
2SO3(g) △H=-197.74 kJ/mol,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如图所示。
下列说法正确的是
①放出的热量Q:Q(甲)>2Q (乙)
②体系总压强p: p (甲) >2p(Z)
③甲容器达到化学平衡时,其化学平衡常数为4
④保持其他条件不变,若起始时向乙中充入0.4 molSO2、0.2mol O2、0.4 molSO3,则此时v(正)>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2 可得到多种燃料,其原理如图所示。

①该工艺中能量转化方式主要有
②电解时,生成乙烯的电极反应式是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol / L,则生成沉淀所需CaCl2溶液的最小浓度为
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=______________ 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______ (填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正_________ v逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加10mL 0.01mol·L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系_____________ ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为_______________ mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:__________________ 。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加10mL 0.01mol·L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


