计算题 较难0.4 引用1 组卷357
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。
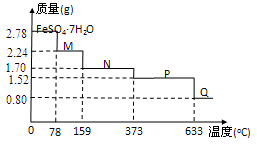
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率( )随温度的变化如图所示。
)随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为______ (填字母)
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=_______ mol/L
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下: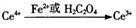
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程_______ 。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率(
当固体残留率为70.3%时,所得固体可能为
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下:
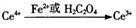
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程
2017·江苏南通·三模
类题推荐
(1) 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由下表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为_______ ,生成硫酸铜的物质的量为________ 。
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2 MnO(OH)2
MnO(OH)2 I2
I2 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程________ 。
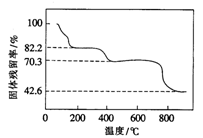
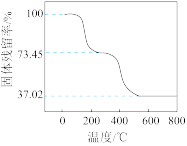
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率( )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=________ 。(写出计算过程)
| 硫 | 氢 | Y | |
| X | 硫 | Z |
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(

钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
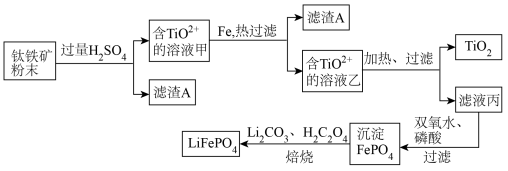
已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是_______ 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________ (填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是__________________________ 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是______ 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为__ (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:
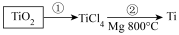
反应②的方程式是___________ 。由TiCl4→Ti需要在Ar气中进行的理由是_____________ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于_________ ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |

已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为
(6)TiO2制取单质Ti,涉及到的步骤如下:
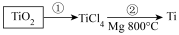
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网