解答题-工业流程题 适中0.65 引用1 组卷223
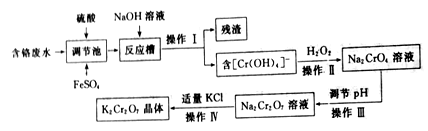
重铬酸钾(K2Cr2O7)是一种常见的强氧化剂,能氧化硫酸亚铁、盐酸等物质。某兴趣小组模拟企业处理含铬废水(主要含Cr2O72-和Cr3+),同时获得重铬酸钾晶体的流程如下:
回答下列问题:
(1)操作I是______ ,残渣的主要成分是______ 。
(2)调节池中发生的主要反应的离子方程式为__________________ 。
(3)操作Ⅲ__________ (填“能”或“不能”)用盐酸调节溶液pH,原因是___________ 。
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至________ 时停止加热。接下来获得K2Cr2O7晶体需要的一系列操作中,下列仪器可能会用到的是__________ (填标号)。
(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为______ mg·L-1(用含c、V的式子表示)。
回答下列问题:
(1)操作I是
(2)调节池中发生的主要反应的离子方程式为
(3)操作Ⅲ
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至
(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为
2017·全国·一模
类题推荐
某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。

已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应:____________________ 。
(2)操作Ⅰ得到的残渣的化学式为____________ 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是__________
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
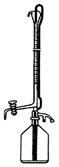
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点____________________ 。
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为_________ mg·L-1(用含a、b的式子表示)。

已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应:
(2)操作Ⅰ得到的残渣的化学式为
(3)操作Ⅲ调节pH时最适合作为调节剂的是
| A.4mol·L-1盐酸 | B.6mol·L-1硫酸 |
| C.石灰乳 | D.碳酸钠 |
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点

②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为
某兴趣小组模拟企业对含铬废水(Cr2O 和Cr3+)处理流程如图(M(Cr)=52g/mol),下列说法
和Cr3+)处理流程如图(M(Cr)=52g/mol),下列说法不正确 的是


| A.调节池中发生的反应为:Cr2O |
| B.操作Ⅰ后得到的残渣主要成分为Fe(OH)3 |
| C.操作Ⅳ制备得到的重铬酸钾中有少量的氯化钠晶体,想要得到纯度较大的重铬酸钾需要重结晶,其具体操作方法为将产品溶于水中,蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| D.为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,调节pH使Cr2O |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网