解答题-原理综合题 较难0.4 引用1 组卷471
(M分)研究碳、氮及其化合物的转化对于环境的改善有重大意义。氧化还原法消除NOx的转化如下:NO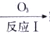 NO2
NO2 N2
N2
已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为_________________ 。
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:_____________________ 。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈_____ (填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_____________ 。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
①该反应的正反应为_________ (填“吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将__________ (填“增大”“减小”或“不变”)。
③计算反应体系在335℃时的平衡常数_______________ 。
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=_____ mol·L-1(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
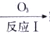 NO2
NO2 N2
N2已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
| 335℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将
③计算反应体系在335℃时的平衡常数
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=
2017·湖南长沙·一模
类题推荐
研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:

已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=—200.9kJ/mol,2NO(g)+O2(g)=2NO(g)△H=—116.2kJ/mol,则NO 与O3 只生成NO2 的热化学方程式为_______ 。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____ ( 填“是”或“否”),依据是_____________________ 。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000molNO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
①结合上表的数据,写出NO与活性炭反应的化学方程式______ ,该反应的正反应为_______ (填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000molNO,再次平衡后,NO 的体积分数将____ (填“增大”、“减小”或“不变”)。
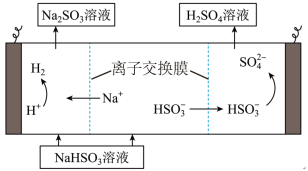
(4)用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示,请写出开始时阳极的电极反应式______________ 。
(5)常温下,Ksp(BaCO3) =2.5×10-9、Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO (aq)=BaCO3(s)+SO
(aq)=BaCO3(s)+SO (aq) ,该反应平衡常数的表达式为K=
(aq) ,该反应平衡常数的表达式为K=_______ ,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于_________ 。
(1)氧化还原法消除NOx的转化如下:

已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=—200.9kJ/mol,2NO(g)+O2(g)=2NO(g)△H=—116.2kJ/mol,则NO 与O3 只生成NO2 的热化学方程式为
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000molNO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②200℃时,平衡后向恒容容器中再充入0.1000molNO,再次平衡后,NO 的体积分数将
(4)用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示,请写出开始时阳极的电极反应式

(5)常温下,Ksp(BaCO3) =2.5×10-9、Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO
研究氮、硫、碳及其化合物的转化对于减少如雾霾、酸雨、酸雾等环境污染问题有重大意义。请回答下列问题:
(1)在一定条件下,CH4可与NO2反应生成对环境无污染的物质。
已知:①CH4的燃烧热:∆H=-890.3 kJ•mol-1②N2(g)+2O2(g)⇌2NO2(g)∆H=+67.0 kJ•mol-1③H2O(g)=H2O(l)∆H=-41.0 kJ•mol-1,则CH4(g)+2NO2 (g) ⇌CO2+2H2O (g)+N2(g)∆H=___ kJ•mol -1。
(2)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
①反应的正反应为________ (填“吸热”或“放热”)反应。
②一定温度下,下列能说明该反应已达到平衡状态的是_______ 。
A. N2与NO 的生成速率相等 B. 混合气体的密度保持不变
C.∆H 保持不变 D. 容器的总压强保持不变
③ 200 ℃时,平衡后向该容器中再充入0.1molNO,再次平衡后,NO的百分含量将______ (填“增大”“减小”或“不变”)。
(3)SO2经催化氧化可制取硫酸,在一定温度下,往一恒容密闭容器中以体积比2∶1,通入SO2和O2,测得容器内总压强在不同温度下与反应时间的关系如图所示。
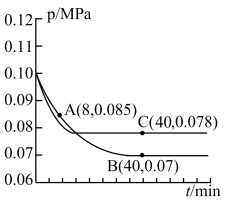
图中C 点时,SO2的转化率为________ 。
②其中C 点的正反应速率υC(正)与A点的逆反应速率υA(逆)的大小关系为:υC(正)____ υA(逆)(填“>”、“<”或“=”)。
(4)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ∆H>0,请你分析该设想能否实现?_____ (填“能”或“否”),依据是__________ 。
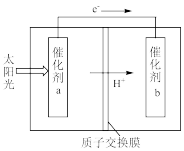
(5)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图所示,在催化剂b表面发生的电极反应为:___________ 。
(1)在一定条件下,CH4可与NO2反应生成对环境无污染的物质。
已知:①CH4的燃烧热:∆H=-890.3 kJ•mol-1②N2(g)+2O2(g)⇌2NO2(g)∆H=+67.0 kJ•mol-1③H2O(g)=H2O(l)∆H=-41.0 kJ•mol-1,则CH4(g)+2NO2 (g) ⇌CO2+2H2O (g)+N2(g)∆H=
(2)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
| 温度 | 固体活性炭/mol | NO/mol | N2/mol | CO2/mol |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②一定温度下,下列能说明该反应已达到平衡状态的是
A. N2与NO 的生成速率相等 B. 混合气体的密度保持不变
C.∆H 保持不变 D. 容器的总压强保持不变
③ 200 ℃时,平衡后向该容器中再充入0.1molNO,再次平衡后,NO的百分含量将
(3)SO2经催化氧化可制取硫酸,在一定温度下,往一恒容密闭容器中以体积比2∶1,通入SO2和O2,测得容器内总压强在不同温度下与反应时间的关系如图所示。

图中C 点时,SO2的转化率为
②其中C 点的正反应速率υC(正)与A点的逆反应速率υA(逆)的大小关系为:υC(正)
(4)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ∆H>0,请你分析该设想能否实现?
(5)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图所示,在催化剂b表面发生的电极反应为:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 NO2
NO2 N2
N2


