解答题-原理综合题 较难0.4 引用1 组卷347
《化学反应原理》模块试题
(1)已知:N2(g)+3H2(g) 2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:
2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:
①若N2、H2的反应速率分别用v(N2)、v(H2)表示,则v(N2) ∶v(H2)=_______________ 。
②若保持其他条件不变,升高温度,平衡________________ (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”),化学平衡常数________________ (填“增大”、“减小”或“不变”)
(2)根据水溶液中离子平衡的相关知识,回答下列问题:
①铝盐、铁盐可作净水剂。铁盐作净水剂的原因是_____________ (用离子方程式表示)
②常温下,柠檬水的pH为3,则溶液中c(OH-)为_______________ 。
③向稀醋酸雜中滴加NaOH溶液至中性,此时溶液中c(CH3COO-)_____ c(Na+)(填“大于”“小于”或“等于”。)
④常温下,向1 mLAgCl饱和溶液中分别加入等体积的以下三种溶液,析出AgCl固体最多的是___________ (填字母)。
A.0.1mol/LNaCl B.0.lmol/LMgCl2 C.0.1.mol/L AlCl3
(3)研究化学能与其他能量的转化对生产和生活活有重要意义。请回答:
①一氧化碳是水煤气的主要成分之—,其燃烧热为283.0kJ/mol,则一氧化碳燃烧的热化学方程式为_____________________________________ 。
②电解法精炼粗铜时,_____________________ 作阳极 。
③下图所示装置中盐桥的作用是__________________ (填字母)
A.使电子通过
B.使两个烧杯中的溶液连成—个通路
C.使ZnSO4溶液和CuSO4溶液均保持电中性
(1)已知:N2(g)+3H2(g)
 2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:
2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:①若N2、H2的反应速率分别用v(N2)、v(H2)表示,则v(N2) ∶v(H2)=
②若保持其他条件不变,升高温度,平衡
(2)根据水溶液中离子平衡的相关知识,回答下列问题:
①铝盐、铁盐可作净水剂。铁盐作净水剂的原因是
②常温下,柠檬水的pH为3,则溶液中c(OH-)为
③向稀醋酸雜中滴加NaOH溶液至中性,此时溶液中c(CH3COO-)
④常温下,向1 mLAgCl饱和溶液中分别加入等体积的以下三种溶液,析出AgCl固体最多的是
A.0.1mol/LNaCl B.0.lmol/LMgCl2 C.0.1.mol/L AlCl3
(3)研究化学能与其他能量的转化对生产和生活活有重要意义。请回答:
①一氧化碳是水煤气的主要成分之—,其燃烧热为283.0kJ/mol,则一氧化碳燃烧的热化学方程式为
②电解法精炼粗铜时,
③下图所示装置中盐桥的作用是
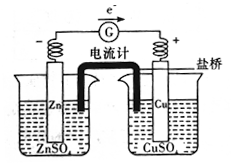
A.使电子通过
B.使两个烧杯中的溶液连成—个通路
C.使ZnSO4溶液和CuSO4溶液均保持电中性
16-17高二下·湖南·期中
类题推荐
运用化学反应原理对研究部分单质及其化合物的反应有重要意义。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
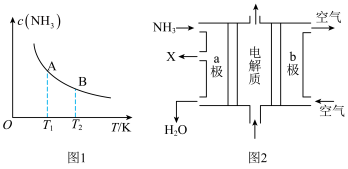
①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=_____ 。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡____ (填“向左”、“向右”或“不”)移动。
②如图中,当温度由T1变化到T2时,KA___ (填“>”、“<”或“=”)KB。
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作____ (填“正”、“负”、“阴”或“阳”)极,其电极反应式为____ 。
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①该反应的平衡常数为_____ 。该温度下,向容器中充入1 mol CO、3 mol H2O、2 mol CO2、1.5 mol H2,则起始时该反应速率v(正)______ (填“>”、“<”或“=”)v(逆)。
②结合表中数据,判断下列说法正确的是_______ (填字母)。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=_____ 。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)

①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=
②如图中,当温度由T1变化到T2时,KA
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g)
| 起始n(CO)∶n(H2O) | CO转化率 | H2O转化率 |
| 1∶1 | 0.5 | 0.5 |
| 1∶2 | 0.67 | 0.33 |
| 1∶3 | 0.75 | 0.25 |
②结合表中数据,判断下列说法正确的是
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=
氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①0~5min内,以CO2表示的该反应速率v(CO2)=______ ,该条件下的平衡常数K=________ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”“逆向”或“不”);最终达平衡时NO的转化率a=______________ 。
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____ 沉淀(填化学式),当两种沉淀共存时,溶液中c(Mg2+)/c(Cu2+)=__________ (已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
合理应用和处理含氮的化合物,在生产生活中有重要意义。
Ⅰ:(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。
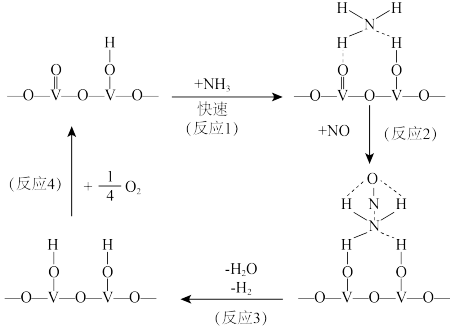
写出总反应化学方程式________________ 。
Ⅱ:已知NO2和N2O4可以相互转化,反应:

(1)在恒容容器中,该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是______ (填字母)。
A.充入一定量NO2 B.分离出一定量NO2
C.充入一定量N2 D.降低温度
(2)若反应 在容积为1 L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,重新达到平衡后,和原平衡相比,混合气体的颜色
在容积为1 L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,重新达到平衡后,和原平衡相比,混合气体的颜色________ (填“变深”“变浅”或“不变”),NO2的转化率________ (填“增大”“减小”或“不变”)。
(3)一定温度下,向容积为20 L的密闭容器中充入1 mol NO2气体:发生反应 。反应中测得相关数据如下表示:
。反应中测得相关数据如下表示:
①此条件下该反应的化学平衡常数
________ 。
②在50 min末,向容器中加入 ,若要保持平衡不发生移动,则应加入的N2O4为
,若要保持平衡不发生移动,则应加入的N2O4为________ mol.
③该温度时,若将9.2 g NO2和N2O4的混合气体充入1 L密闭容器中,某时刻测得容器内气体的平均相对分子质量为56,则此时v正(NO2)_________ v逆(NO2)(填“>”“=”或“<”)。
Ⅰ:(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。

写出总反应化学方程式
Ⅱ:已知NO2和N2O4可以相互转化,反应:
(1)在恒容容器中,该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是
A.充入一定量NO2 B.分离出一定量NO2
C.充入一定量N2 D.降低温度
(2)若反应
(3)一定温度下,向容积为20 L的密闭容器中充入1 mol NO2气体:发生反应
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数
②在50 min末,向容器中加入
③该温度时,若将9.2 g NO2和N2O4的混合气体充入1 L密闭容器中,某时刻测得容器内气体的平均相对分子质量为56,则此时v正(NO2)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


