解答题-原理综合题 较难0.4 引用1 组卷376
汽车尾气(主要成分为CO和NO)是形成雾霾的原因之一,对汽车尾气的处理也成为科学家研究的热点。
已知:I. N2(g)+O2(g) 2NO(g) ΔH= +180.7 IkJ • mol-1;
2NO(g) ΔH= +180.7 IkJ • mol-1;
Π . 2NO(g)+2CO(g) N2(g) + 2CO2(g) ΔH=-746.5 kj • mol-1。
N2(g) + 2CO2(g) ΔH=-746.5 kj • mol-1。
请回答下列问题:
(1)CO的燃烧热ΔH =____________ 。
(2)Ti℃时,向10 L容积不变的密闭容器中充人1 mol NO和1 mol CO,发生反应Π。5 min达到平衡时测得容器中CO2的物质的量为0.8 mol。则:
①0〜5 min内,用N2表示的平均反应速率 (N2)=
(N2)=______________ 。 .
②Ti℃时,该反应的平衡常数K=_______________ 。
③下列事实能说明该反应一定达到平衡状态的是______________ (填选项字母)。
A.气体压强保持不变 B. 保持不变
保持不变
C.气体密度保持不变 D.速率之比: =1
=1
④保持其他条件不变,平衡后再向该容器中充人1 mol NO、l molCO、0.5 mol N2、l molCO2,此时
 正
正_______ (填“>”“<”或“ =”)  逆
逆
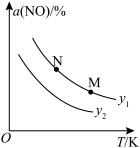
(3)—定条件下,向密闭容器中充入一定量的N2、O2和CO,发生反应I和反应Ⅱ,容器中N2的平衡转化率(α)与温度(T)和压强(p)的关系如图所示。则:
①α(N2)随温度升高而____________ (填“增大”或“减小”),理由为________________ 。
②M点和N点对应体系中,NO的体积分数:M______________ (填“>”“<”“ = ”)N。
已知:I. N2(g)+O2(g)
Π . 2NO(g)+2CO(g)
请回答下列问题:
(1)CO的燃烧热ΔH =
(2)Ti℃时,向10 L容积不变的密闭容器中充人1 mol NO和1 mol CO,发生反应Π。5 min达到平衡时测得容器中CO2的物质的量为0.8 mol。则:
①0〜5 min内,用N2表示的平均反应速率
②Ti℃时,该反应的平衡常数K=
③下列事实能说明该反应一定达到平衡状态的是
A.气体压强保持不变 B.
C.气体密度保持不变 D.速率之比:
④保持其他条件不变,平衡后再向该容器中充人1 mol NO、l molCO、0.5 mol N2、l molCO2,此时
(3)—定条件下,向密闭容器中充入一定量的N2、O2和CO,发生反应I和反应Ⅱ,容器中N2的平衡转化率(α)与温度(T)和压强(p)的关系如图所示。则:
①α(N2)随温度升高而
②M点和N点对应体系中,NO的体积分数:M
2017·重庆·二模
类题推荐
已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=___________ kJ·mol-1。
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
(3)CO和NO2也可反应,热化学方程式为2NO2(g)+4CO(g)⇌N2(g)+4CO2(g) ΔH4<0。T℃时,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如下:
①0~5min内,v正(CO2)=________ mol·L-1·min-1;该温度下反应的化学平衡常数K=________ (用分数表达)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率___________ (填“增大”、“减小”或“不变”,下同),混合气体的密度___________ 。
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正___________ v逆(填“>”“<”或“=”)。
①N2(g)+O2(g)⇌2NO(g) ΔH1=+180kJ·mol-1
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若已知CO的燃烧热即ΔH3=-283.5kJ·mol-1,则反应②的ΔH2=
(2)若在恒温恒容密闭容器中充入2molCO(g)和1molNO(g),发生反应②,下列选项中能说明反应已达到平衡状态的是___________(填标号)。
| A.CO和NO的物质的量之比不变 | B.该反应的化学平衡常数不变 |
| C.混合气体的压强保持不变 | D.v正(N2)=2v逆(CO) |
| 0min | 5min | 10min | 15min | 20min | |
| n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
| n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
②其他条件不变,升高温度,NO2的平衡转化率
③20min时,将容器改为恒温恒压且体积仍为2L,再向容器中通入0.4molCO、0.7molN2和0.4molCO2,此时v正
已知汽车尾气排放时容易发生以下反应:
Ⅰ.N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
Ⅱ.2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH2
N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=_______ kJ·mol-1。
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是_______ (填标号)。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
①0~5 min内,v正(CO2)=_______ mol·L-1·min-1;该温度下反应的化学平衡常数K=_______ (保留两位有效数字)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率_______ (填“增大”、“减小”或“不变”,下同),混合气体的密度_______ 。
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正_______ v逆(填“>”“<”或“=”)。
Ⅰ.N2(g)+O2(g)
Ⅱ.2CO(g)+2NO(g)
请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g)
| 0 min | 5 min | 10 min | 15 min | 20 min | |
| c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②其他条件不变,升高温度,NO2的平衡转化率
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网