解答题-原理综合题 适中0.65 引用3 组卷649
合理的利用吸收工业产生的废气CO2、NO2、SO2等可以减少污染,变废为宝。
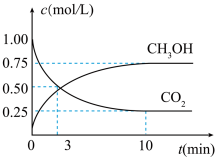
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(l) △H=-a kJ•mol﹣1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:___________ 。
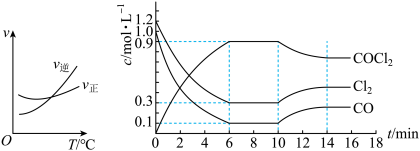
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g) △H<0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
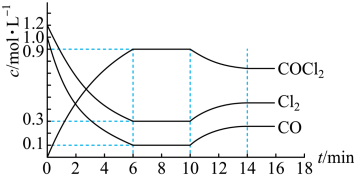
图1
①0~6min内,反应的平均速率v(Cl2)=___________ ;
②该反应第一次达平衡时的平衡常数为___________ ,10min改变的条件是___________ 。
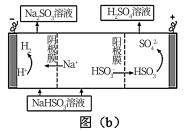
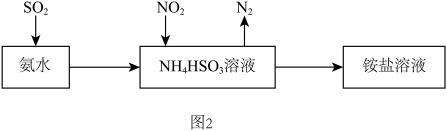
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________ 。
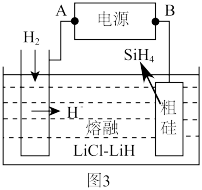
(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___________ 极,电解时阳极的电极反应式为___________ 。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(l) △H=-a kJ•mol﹣1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)⇌COCl2(g) △H<0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

图1
①0~6min内,反应的平均速率v(Cl2)=
②该反应第一次达平衡时的平衡常数为
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的

2017·北京·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网