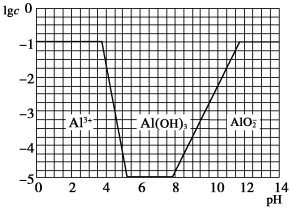
填空题 适中0.65 引用1 组卷414
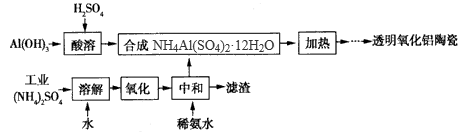
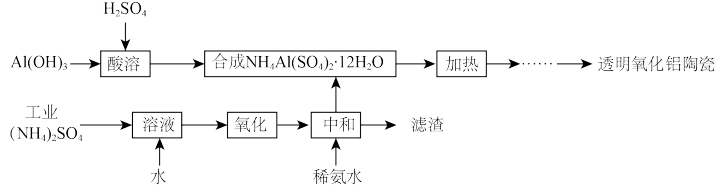
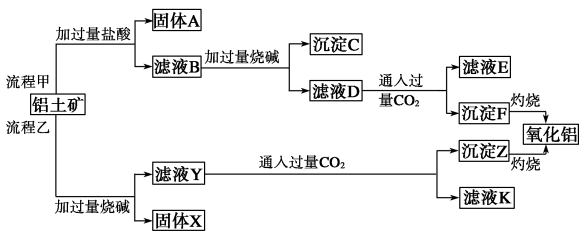
以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如右图所示:
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为________________ 。
(2)当25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.75×105。(NH4)2SO4溶液呈酸性,其原因是(用力方程式解释):__________ ;该离子方程式的平衡常数K约为______ (填具体数字)。
(3)如何检验中和液中的杂质离子已完全除尽_________ 。
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为__________ 。
(5)综上分析,流程图中M的主要成分的化学式为________ ,M可用一种物质吸收以实现循环利用,该物质的名称是_________ 。
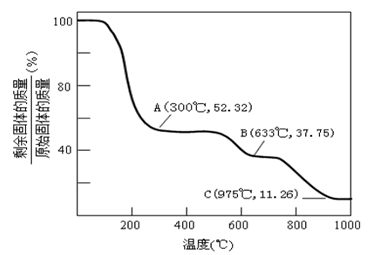
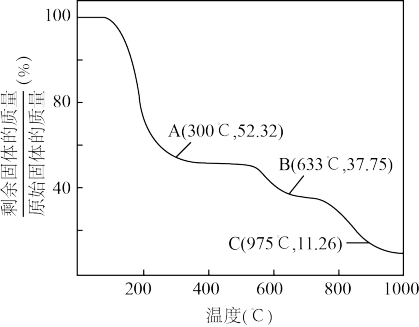
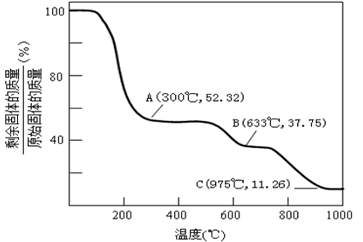
(6)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为_____________ 。

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为
(2)当25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.75×105。(NH4)2SO4溶液呈酸性,其原因是(用力方程式解释):
(3)如何检验中和液中的杂质离子已完全除尽
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为
(5)综上分析,流程图中M的主要成分的化学式为
(6)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为
2017·四川广元·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网