解答题-原理综合题 适中0.65 引用1 组卷573
煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________ ;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________ 。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________ 。
②列式并计算该反应在700℃时的化学平衡常数K=__________ ,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________ (填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:| 反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| 5 | 0.80 | |
| 10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:
②列式并计算该反应在700℃时的化学平衡常数K=
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
2017·全国·一模
知识点:盖斯定律与热化学方程式盖斯定律与热化学方程式化学平衡的移动及其影响因素化学平衡的移动及其影响因素化学平衡常数的有关计算化学平衡常数的有关计算反应进行方向判据的应用反应进行方向判据的应用 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
(一)煤化工中常需研究不同温度下的平衡常数、产率及不同投料比对反应方向的影响等问题。已知反应CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
试回答下列问题。
(1)该反应的化学平衡常数表达式为K=________ 。
(2)在相同条件下,为增大反应物的转化率,该反应应在______ (填“高温”或“低温”)条件下进行。
(3)在830 ℃时发生上述反应,按下表中的物质的量将各物质投入恒容反应器中,其中向正反应方向进行的反应有________ (填序号)。
(二)氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:
I:2 (aq)+3O2(g)=2
(aq)+3O2(g)=2 (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2 (aq)+O2(g)=2
(aq)+O2(g)=2 (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的 (aq)氧化生成
(aq)氧化生成 (aq)的热化学方程式为
(aq)的热化学方程式为____________________ 。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____ (填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____ (填“正反应”或“逆反应”)方向移动,判断理由是____ 。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___ (填字母)。
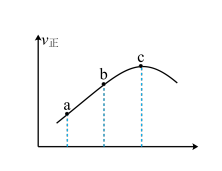
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的化学平衡常数表达式为K=
(2)在相同条件下,为增大反应物的转化率,该反应应在
(3)在830 ℃时发生上述反应,按下表中的物质的量将各物质投入恒容反应器中,其中向正反应方向进行的反应有
| 选项 | A | B | C | D |
| n(CO2)/mol | 3 | 1 | 0 | 1 |
| n(H2)/mol | 2 | 1 | 0 | 1 |
| n(CO)/mol | 1 | 2 | 3 | 0.5 |
| n(H2O)/mol | 5 | 2 | 3 | 2 |
(1)微生物作用下,废水中的
I:2
II:2
则低浓度氨氮废水中的
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)
 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是

A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
CO是煤气的主要成分之一,H2S是许多煤化工产品的原料气。工业上,生产水煤气的主要反应如下:
Ⅰ.H2O(g)+C(s)=CO(g)+H2(g) △H=x kJ·mol-1
Ⅱ. CO(g)+H2O(g) H2(g)+CO2(g) △H =-41.2kJ • mol-1
H2(g)+CO2(g) △H =-41.2kJ • mol-1
(1)已知:2C(8)+O2(g)=2CO(g) △H =-220kJ • mol-1;利用下表中几种共价键的键能可以确定氢气
燃烧生成气态水的热化学反应方程式。
则H2O(g)+C(s)=CO(g)+H2(s) △H=___________ kJ·mol-1
(2)一定温度下,在1.0L密闭容器中放入1molC(s)、1molH2O(g)进行反应,反应时间(f)与容器内气体总压强(P)的数据如图:
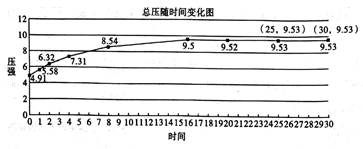
回答下列问题:
①下列事实能够说明该反应达到平衡状态的是________ (填序号)。
a.各反应物和生成物浓度相等 b.该反应的△H不变
c. v正(CO)=v逆(H2) d.混合气体的平均相对分子质量不变
②由图中数据计算,该反应的平衡常数K=___________ (精确到小数点后第二位)。
(3)现有两个体积相同的2L恒容密闭容器M、N,在M中充入1mol CO和1mol H2O,在N中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应,达到平衡时,容器M中CO的转化率α1与容器N中CO2的转化率α2的关系为________ (写数学表达式)。
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______________ ;
常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL (标况)H2S气体,反应后溶液中的离子浓度由大到小的顺序为____________________ 。
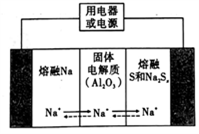
(5)硫化氢高温分解得到单质硫,钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池的总反应为2Na+xS Na2Sx(3,反应原理如图17所示;则电池放电时,正极反应式为:
Na2Sx(3,反应原理如图17所示;则电池放电时,正极反应式为:_____________________ 。
Ⅰ.H2O(g)+C(s)=CO(g)+H2(g) △H=x kJ·mol-1
Ⅱ. CO(g)+H2O(g)
 H2(g)+CO2(g) △H =-41.2kJ • mol-1
H2(g)+CO2(g) △H =-41.2kJ • mol-1(1)已知:2C(8)+O2(g)=2CO(g) △H =-220kJ • mol-1;利用下表中几种共价键的键能可以确定氢气
燃烧生成气态水的热化学反应方程式。
| 化学键 | O=O | H-H | O-H |
| 键能(kJ/mol) | 496 | 436 | 462 |
则H2O(g)+C(s)=CO(g)+H2(s) △H=
(2)一定温度下,在1.0L密闭容器中放入1molC(s)、1molH2O(g)进行反应,反应时间(f)与容器内气体总压强(P)的数据如图:

回答下列问题:
①下列事实能够说明该反应达到平衡状态的是
a.各反应物和生成物浓度相等 b.该反应的△H不变
c. v正(CO)=v逆(H2) d.混合气体的平均相对分子质量不变
②由图中数据计算,该反应的平衡常数K=
(3)现有两个体积相同的2L恒容密闭容器M、N,在M中充入1mol CO和1mol H2O,在N中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应,达到平衡时,容器M中CO的转化率α1与容器N中CO2的转化率α2的关系为
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| 电离平衡常数 | H2CO3 | H2S |
| Ka1 | 4.4×l0-7 | 1.3×l0-7 |
| Ka2 | 4.7×10-11 | 7. l×l0-15 |
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL (标况)H2S气体,反应后溶液中的离子浓度由大到小的顺序为
(5)硫化氢高温分解得到单质硫,钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池的总反应为2Na+xS
 Na2Sx(3,反应原理如图17所示;则电池放电时,正极反应式为:
Na2Sx(3,反应原理如图17所示;则电池放电时,正极反应式为:
CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
① ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为_______ 。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_______ 。
a.若混合气体密度保持不变,则已达平衡状态
b.达平衡后若再充入一定量CO2,平衡常数保持不变
c.分离出部分S,正、逆反应速率均保持不变,平衡不移动
d.从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通入2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应: ,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是
,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_______ (用a、b、c表示),实验a从反应开始至45 s达到平衡,则该过程反应速率v(SO2)=_____ (结果保留2位有效数字)。
(2)利用 CO、H2可制备天然气,主要反应为:
 ;
;
 ;
;
 。
。
回答下列问题:
①反应CO2(g)+4H2(g) CH4(g) +2H2O(1)的△H4=
CH4(g) +2H2O(1)的△H4=_______ kJ/mol。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加入1 mol CO2和4 mol H2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是_______ (填“A”或“B”)。
②在恒压管道反应器中按n(H2):n(CO)=3:1,通入原料气,在催化剂作用下制备合成天然气,400℃时p总为100 kPa时反应体系平衡组成如下表所示:
则该条件下CO的总转化率α=_______ 。
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应Ⅰ:
反应Ⅱ:
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是_______ 。
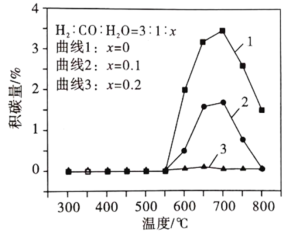
A.曲线1在700-800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B.曲线1在550~700℃积碳量增大的原因可能是反应Ⅰ、Ⅱ的速率增大
C.曲线2、3在550-800℃积碳量较低的主要原因是水蒸气稀释作用使积碳反应速率减小
D.水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
(1)CO还原法处理大气污染物SO2
①
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是
a.若混合气体密度保持不变,则已达平衡状态
b.达平衡后若再充入一定量CO2,平衡常数保持不变
c.分离出部分S,正、逆反应速率均保持不变,平衡不移动
d.从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通入2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:
| 时间(s) 压强(kPa) 组别 | 0s | 40s | 45s | 60s |
| a | 175 | 140 | 140 | 140 |
| b | 160 | 120 | 120 | 120 |
| c | 160 | 130 | 125 | 120 |
回答下列问题:
①反应CO2(g)+4H2(g)
②在恒压管道反应器中按n(H2):n(CO)=3:1,通入原料气,在催化剂作用下制备合成天然气,400℃时p总为100 kPa时反应体系平衡组成如下表所示:
| 组分 | CH4 | H2O | H2 | CO2 | CO |
| 体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应Ⅰ:
反应Ⅱ:
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是

A.曲线1在700-800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B.曲线1在550~700℃积碳量增大的原因可能是反应Ⅰ、Ⅱ的速率增大
C.曲线2、3在550-800℃积碳量较低的主要原因是水蒸气稀释作用使积碳反应速率减小
D.水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


