解答题-原理综合题 较难0.4 引用1 组卷413
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为___________ 。已知N2O与CO2分子具有相似的结构,试画出N2O的结构式_______ 。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g) N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式___________ 。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g) N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________ (用p总、各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的____ 极,电解池中生成N2O5的电极反应式为_____________ 。
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式_____________ 。
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少____ ml氨气,使溶液呈中性(溶液的体积变化忽略不计)。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g)
 N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g)
 N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的
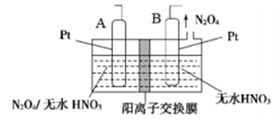
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少
2017·湖北黄冈·三模
类题推荐
研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________ 。
(2)N2O4与NO2转化的热化学方程式为N2O4(g) 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________ (填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________ (填“变深”“变浅”或“不变”),判断理由______________________________________ 。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________ (用p总、各气体物质的量分数x表示);影响K的因素为________ 。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________ (填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________ 。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________ 。
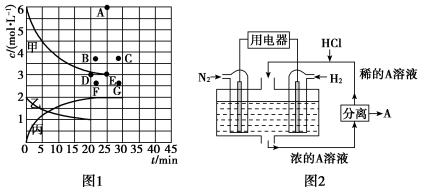
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________ ,A是_______________________________ 。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
| 化学键 | N—H | N—N | N≡N | O—H |
| 键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2转化的热化学方程式为N2O4(g)
 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是

(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是
(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:
① 写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)
 2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJ•mol﹣1,其化学平衡常数K值和温度的关系如下:| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
① 写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
 CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1