解答题-原理综合题 适中0.65 引用2 组卷293
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____ 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
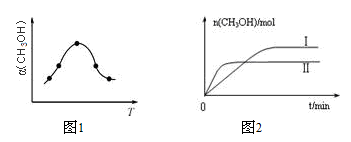
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____ 0(填“>”、“<”或“=”,下同)。
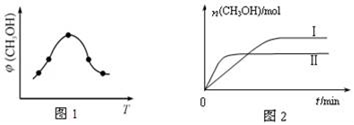
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____ KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比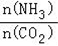 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____ 。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____ (填“酸性”、“中性”或“碱性”)。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol﹣1
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H

②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比
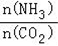 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈
16-17高二上·湖北宜昌·期末
类题推荐
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭(石墨)作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s)+ 3C(石墨)=2Fe(s)+ 3CO(g)△H 1 = +489.0 kJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为__________________________ 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
若向体积为1L的恒容密闭容器中按下表中三种投料方式投料,发生上述反应.反应温度对CO2平衡转化率影响的曲线(如下图)。
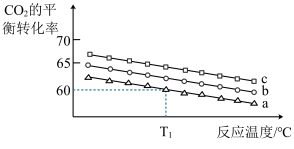
① 该反应的△H_______ 0(填“>”“<”或“=” ),曲线C对应的投料是第_________ 组。
② T1℃ 时,曲线a对应的化学平衡常数K=_________ (保留两位有效数字)。
③ 若500℃ 时该反应的平衡常数K= 2.5,T1℃________ 500℃ (填“>”“<”或“=”)。
(3)用电化学的方法也可以将CO2变废为宝,用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应式为____________ 。
(4)用石灰水就能够将CO2转变成CaCO3,若Ksp(CaCO3)=2.8×10-9,饱和石灰水的物质的量浓度为0.01mol/L,则向1L饱和石灰水中通入_______ mLCO2(标准状况),溶液中开始出现沉淀(不考虑反应过程中溶液体积的变化)。
(1)将CO2与焦炭(石墨)作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s)+ 3C(石墨)=2Fe(s)+ 3CO(g)△H 1 = +489.0 kJ·mol-1
②C(石墨)+CO2(g)=2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
若向体积为1L的恒容密闭容器中按下表中三种投料方式投料,发生上述反应.反应温度对CO2平衡转化率影响的曲线(如下图)。

| 组序号 | 1 | 2 | 3 |
| n(CO2) | 1mol | 1mol | 1mol |
| n(H2) | 3mol | 4mol | 6mol |
② T1℃ 时,曲线a对应的化学平衡常数K=
③ 若500℃ 时该反应的平衡常数K= 2.5,T1℃
(3)用电化学的方法也可以将CO2变废为宝,用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应式为
(4)用石灰水就能够将CO2转变成CaCO3,若Ksp(CaCO3)=2.8×10-9,饱和石灰水的物质的量浓度为0.01mol/L,则向1L饱和石灰水中通入
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示: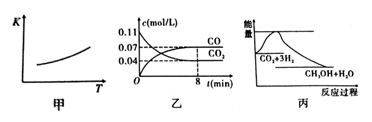
 CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。 CH3OH(l)+H2O(l) △H=-143.0kJ•mol-1;
CH3OH(l)+H2O(l) △H=-143.0kJ•mol-1; CH3OH(g)+H2O(g) △H取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
CH3OH(g)+H2O(g) △H取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。