填空题 较难0.4 引用1 组卷562
磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________ 。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
①平衡常数K:溶液II____ 溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____ 容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
阴极的电极反应式为_______ ;产品室中反应的离子方程式为__________ 。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________ 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______ mol/L
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)
 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)| 编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| I | 320 | 0.40 | 0.10 | 0.10 | t1 |
| II | 320 | 0.80 | t2 | ||
| III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II
②反应达到平衡时,PCl3的转化率:容器II
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
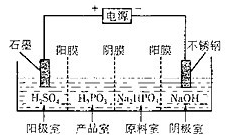
阴极的电极反应式为
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成
16-17高三下·广西南宁·阶段练习
类题推荐
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
①分析数据可知:大气固氮反应属于_____ (填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____ 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO +NO
+NO +
+_____ =Mn2++NO +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
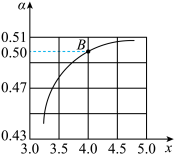
其它条件不变时,α随着x增大而增大的原因是____ ;图中的B点处NH3的平衡转化率为____ 。
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________ 。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___ (用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__ 沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______ mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)

其它条件不变时,α随着x增大而增大的原因是
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成
完成下列问题
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3 H++H2PO
H++H2PO ,H2PO
,H2PO
 H++HPO
H++HPO

回答下列问题:
①Na2HPO3属于___________ (填“正盐”或“酸式盐”)。
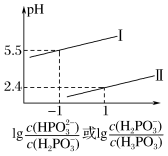
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线___________ (填“I”或“Ⅱ”),亚磷酸(H3PO3)的Ka2=___________ 。
(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
①向Na2CO3溶液中加入少量的H3PO4溶液反应的离子方程式是___________ 。
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是___________ 。
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___________ 。(100℃时:Kw=10-12)
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=___________ 。
(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是___________ (已知lg2=0.3)。
(1)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(H3PO3)的结构如图,亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡:H3PO3

回答下列问题:
①Na2HPO3属于
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示

(2)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
| 弱酸 | NH3·H2O | HNO2 | H2CO3 | H3PO4 |
| 电离平衡常数(25℃) | Kb=1.8×10-5 | Ka=5.0×10-4 | Ka1=4.0×10-7 Ka2=5.0×10-11 | Ka1=8.0×10-3 Ka2=6.0×10-8 Ka3=2.0×10-13 |
②0.1mol/L的NH4NO2溶液中离子浓度大小关系是
(3)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
(4)已知:Ksp(AgBr)=5.4×10−13,Ksp(AgCl)=1.8×10−10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
(5)已知在25℃时,Ksp[Mg(OH)2]=3.2×10−11.25℃时,向0.02 mol∙L−1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的pH最小是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2HI(g)
2HI(g)