解答题-实验探究题 适中0.65 引用2 组卷694
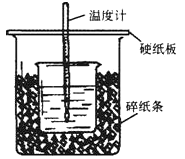
(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________ 。

(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量________ (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______ (填“偏大”、“偏小”或“无影响”).
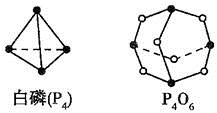
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: :
: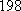 kJ·mol-1,
kJ·mol-1, :
: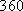 kJ·mol-1,
kJ·mol-1,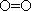 :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为__________________ 。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式___________________ 。
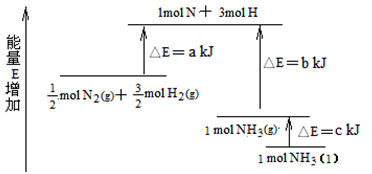
(7)化学反应N2+3H2 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________ 。
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出

(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能:
 :
: kJ·mol-1,
kJ·mol-1, :
: kJ·mol-1,
kJ·mol-1, :
: kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
kJ·mol-1,则反应P4(白磷) +3O2=P4O6的热化学反应方程式为
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式
(7)化学反应N2+3H2
 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是
16-17高二下·福建厦门·开学考试
类题推荐
Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________________
(2)在测定中和热的实验中,计算反应热时需要的数据有________________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),所放出的热量____ (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_____ (填“偏大”、“偏小”或“无影响”).
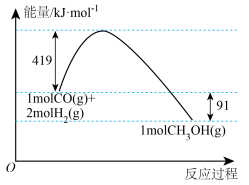
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g) CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________ 。
(2)H—O键的键能x为_________ kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________ kJ/mol。

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出
(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)
 CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能| 化学键 | H-H | H-O | O=O |
| 键能kJ/mol | 436 | x | 496 |

②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式
(2)H—O键的键能x为
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为
(1)已知:①N2(g)+2O2(g)=N2O4(l)∆H1=-195kJ•mol-1 ②N2H4(l)+O2(g)=N2(g)+2H2O(g)∆H2=-534kJ•mol-1;写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:______
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
则H2(g)+Cl2(g)=2HCl(g)的反应热ΔH为_______
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
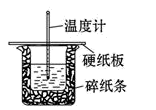
①从实验装置上看,图中尚缺少的一种玻璃用品是______ 。缺少用品不能改为金属(如铜),其原因是_________ 。
②烧杯间填满碎纸条的作用是_________ 。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值 会______ 。(填“偏大”、“偏小”、“无影响”)。
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②烧杯间填满碎纸条的作用是
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网