解答题-原理综合题 较难0.4 引用1 组卷358
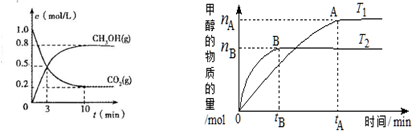
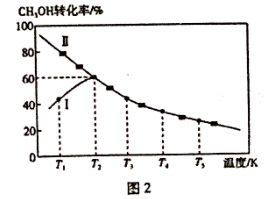
乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都都采用甲醇与CO反应来制备.某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g) CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g) CH3COOH(I) △H=
CH3COOH(I) △H= ______ kJ·mol-1
(2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为_________ mol·min-1.
(3)在温度为T2时,该反应的平衡常数K=_________ ;在T3温度下,C点时,ν(正) ____ ν(逆)(填“>”、“<”或“=” )。
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为__________ (填“向左”或“向右”或“不移动” )
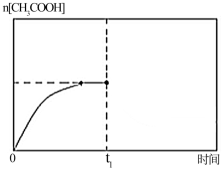
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
__________
 CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.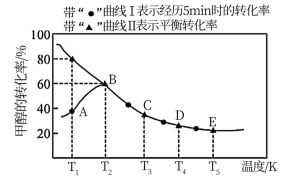
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g)
 CH3COOH(I) △H=
CH3COOH(I) △H= (2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为
(3)在温度为T2时,该反应的平衡常数K=
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
2017·河北衡水·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网