解答题-原理综合题 适中0.65 引用7 组卷380
雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O
①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)__________
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)__________
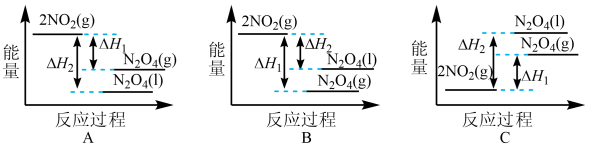
已知:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g) N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:__________ .
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是__________ 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O CO+3H2的平衡常数K=
CO+3H2的平衡常数K=__________ ;
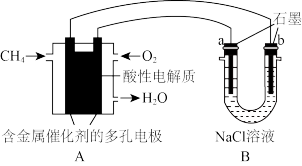
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。__________
②电解后溶液的pH=__________ (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是__________ L。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO
①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)

B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)
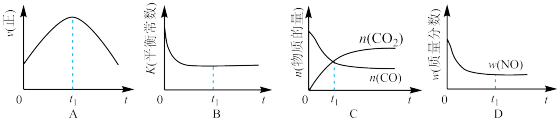
已知:CH4(g)+2NO2(g)
2NO2(g)
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
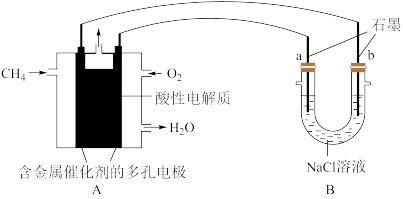
②电解后溶液的pH=
③阳极产生气体的体积在标准状况下是
16-17高三上·河北衡水·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网