填空题 较难0.4 引用1 组卷533
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ﹒脱硝:
已知:H2的燃烧热为285.8kJ·mol—1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol—1
H2O(g)=H2O(l) ΔH=—44kJ·mol—1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_________________ ;
Ⅱ﹒脱碳:
向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH﹤0
CH3OH(l)+H2O(l) ΔH﹤0
⑴①该反应自发进行的条件是___________ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是_________ (填字母)
A﹒混合气体的平均相对分子质量保持不变
B﹒CO2和H2的体积分数保持不变
C﹒CO2和H2的转化率相等
D﹒混合气体的密度保持不变
E﹒1molCO2生成的同时有3molH—H键断裂
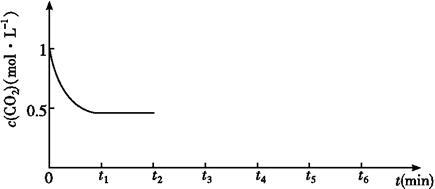
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化曲线。_________
⑵改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)_______ K(Ⅱ)(填“﹥”“﹤”或“=”)
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=________________ 。在其他条件不变的情况下,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡________ 移动(填“正向”“逆向”或“不”)。
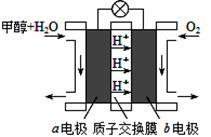
⑶利用CO与H2可直接合成甲醇,下图是由“甲醇—空气”形成的绿色燃料电池的工作原理
示意图,写出以石墨为电极的电池工作时负极的电极反应式_________
Ⅰ﹒脱硝:
已知:H2的燃烧热为285.8kJ·mol—1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol—1
H2O(g)=H2O(l) ΔH=—44kJ·mol—1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:
Ⅱ﹒脱碳:
向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ΔH﹤0
CH3OH(l)+H2O(l) ΔH﹤0⑴①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
A﹒混合气体的平均相对分子质量保持不变
B﹒CO2和H2的体积分数保持不变
C﹒CO2和H2的转化率相等
D﹒混合气体的密度保持不变
E﹒1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化曲线。

⑵改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:| 反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=
⑶利用CO与H2可直接合成甲醇,下图是由“甲醇—空气”形成的绿色燃料电池的工作原理
示意图,写出以石墨为电极的电池工作时负极的电极反应式

16-17高三上·广东揭阳·期中
类题推荐
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g) = 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为_____
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 :
CO2(g)+3H2(g) ⇌ CH3OH(l)+H2O(l)。下列叙述能说明此反应达到平衡状态的是________ 。
A.混合气体的平均摩尔质量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)改变温度,使反应CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g)△H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应I、II对比:平衡时CH3OH的浓度c(I)___________ c(II)。(填“>”“<”或“=”,下同);将反应I的条件改为绝热恒容,平衡时的平衡常数与反应I的比较_________ (填“增大”“减小”或“不变”)
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=________ ,在其他条件不变下,将温度改为T2,测得30min时,H2的物质的量为3.2mol,则T1____ T2(填“>”“<”或“=”)若30min时只向容器中再冲入1molCO2(g)和1molH2O(g),则平衡_______ 移动(填“正向”、“逆向”或“不”)
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①甲烷燃料电池的负极反应式:____________________________________
②电解后溶液的pH=__________________________ (忽略氯气与氢氧化钠溶液反应)。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g) = 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 :
CO2(g)+3H2(g) ⇌ CH3OH(l)+H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均摩尔质量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)改变温度,使反应CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g)△H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
| 恒温恒容 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I | 0 min | 2 | 6 | 0 | 0 |
| 10 min | 4.5 | ||||
| 20 min | 1 | ||||
| 30 min | 1 | ||||
| 反应II | 0 min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①甲烷燃料电池的负极反应式:
②电解后溶液的pH=
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
脱碳:向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0
(1)下列叙述能说明此反应达到平衡状态的是___________
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
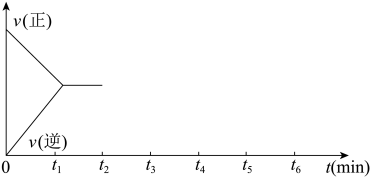
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。该反应的速率随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6反应速率随时间的变化曲线并标出正逆反应速率
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。该反应的速率随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6反应速率随时间的变化曲线并标出正逆反应速率___________ 。
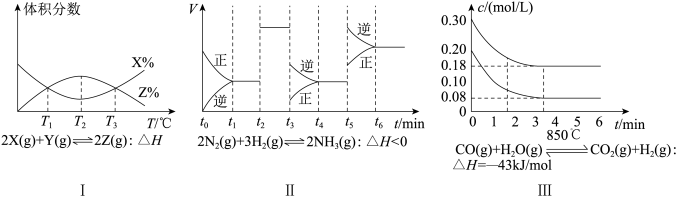
(3)根据有关图象,说法正确的是___________
(4)反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,起始温度、体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见表:
CH3OH(g)+H2O(g) ΔH<0,起始温度、体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见表:
达到平衡时,反应Ⅰ、Ⅱ、Ⅲ平衡常数K(Ⅰ)、K(Ⅱ)、K(Ⅲ)的大小关系___________ (填“﹥”“<”或“=”),对反应Ⅰ和Ⅲ,CO2的平衡转化率α(Ⅰ)___________ α(Ⅲ)(填“>”“<”或“=”),反应Ⅰ和Ⅱ,CH3OH平衡时的体积分数w(Ⅰ)___________ w(Ⅱ)(填“>”“<”或“=”)。
脱碳:向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生反应:CO2(g)+3H2(g)
(1)下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
(2)改变温度,使反应CO2(g)+3H2(g)

(3)根据有关图象,说法正确的是___________

| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的∆H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.Ⅲ在10 L容器、850℃时反应,由图知,到4 min时,反应放出51.6 kJ的热量 |
| 反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
| 反应Ⅲ:恒温恒压 | 0 min | 2 | 6 | 0 | 0 |
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___ 。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___ 。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g) CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____ (选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___ 点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g) C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
该反应是____ 反应(填“吸热反应”或“放热反应”);反应初始至平衡,A的平均反应速率v(A)=_____ 。达到平衡后,B的转化率为____ 。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
(3)已知反应A(g)+B(g)
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
该反应是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


