填空题 较难0.4 引用1 组卷213
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H________ 0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为___________ 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是____________ 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________ 移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________ ;图中表示平衡混合物中SO3的含量最高的一段时间是____________ 。
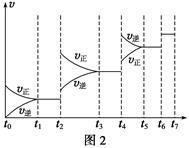
(7)各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4之间的关系为__________________ 。
I.已知:NO2(g)+SO2(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H
II.对于反应2SO2(g)+O2(g)
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
16-17高二上·黑龙江大庆·期中
类题推荐
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应2A(g) + B(g)⇌3C(g) ΔH>0,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。
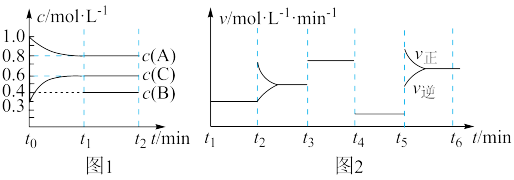
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________ 。
(2)t4~t5阶段改变的条件为_______ ,B的起始物质的量为______ 。各阶段平衡时对应的平衡常数如表所示:
则K1=______ (计算式),K1、K2、K3、K4、K5之间的关系为_____ (用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:2A(g) + B(g)⇌3C(g) ΔH,用含有a的代数式表达 ΔH =________ 。
(4)在相同条件下,若起始时容器中加入4mol A、2 mol B和1.2 mol C,达到平衡时,体系中 C的百分含量比t1时刻C的百分含量_____ (填“大于”“小于”“等于”)。
(5)能说明该反应已达到平衡状态的是______ 。
a.v(A)=2v(B) b.容器内压强保持不变
c.2v逆(c)=3v正(A) d.容器内密度保持不变
(6)为使该反应的反应速率增大,且平衡向正反应方向移动的是____ 。
a.及时分离出C气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂

(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4~t5阶段改变的条件为
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:2A(g) + B(g)⇌3C(g) ΔH,用含有a的代数式表达 ΔH =
(4)在相同条件下,若起始时容器中加入4mol A、2 mol B和1.2 mol C,达到平衡时,体系中 C的百分含量比t1时刻C的百分含量
(5)能说明该反应已达到平衡状态的是
a.v(A)=2v(B) b.容器内压强保持不变
c.2v逆(c)=3v正(A) d.容器内密度保持不变
(6)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出C气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 N2(g)+2CO2(g)
N2(g)+2CO2(g)