解答题-原理综合题 适中0.65 引用1 组卷351
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___ kJ·mol-1。
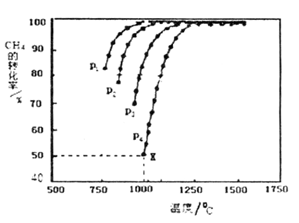
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
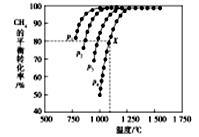
①下列事实能说明该反应一定达到平衡的是____ 。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______ ,理由是____ 。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____ ,NH4+水解平衡常数KA=____ 。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________ 。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

①下列事实能说明该反应一定达到平衡的是
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式
16-17高三上·湖南长沙·周测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO2(g)
2CO2(g) CO2(g)+2H2O(g)
CO2(g)+2H2O(g)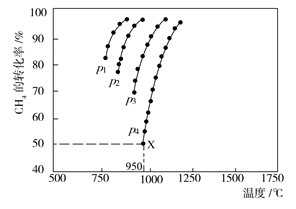
 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L−1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图所示:v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L−1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图所示:v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线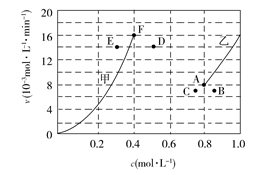 .
. 2NO(g)
2NO(g)



