解答题-实验探究题 较难0.4 引用1 组卷97
(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是__________ 。
①B装置的作用是______________ 。
②M干燥管中所放的药品是________________ 。
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是_______ (填化学式);检验是否完全变质的实验方法是___________________ 。
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O +2Fe2+ =2Fe3++2SO
+2Fe2+ =2Fe3++2SO )。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
①完成上述实验需要准确量取20.00 mL过二硫酸铵溶液,所用仪器的名称是______________ 。
②根据上述数据计算,样品的纯度为______________ (用含w、c的代数式表示)。

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是
①B装置的作用是
②M干燥管中所放的药品是
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②根据上述数据计算,样品的纯度为
16-17高三上·贵州铜仁·阶段练习
类题推荐
(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;
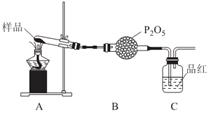
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
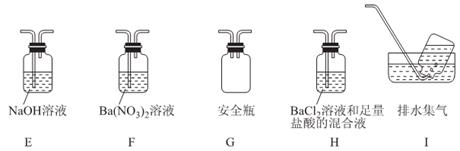
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

硫氰化钾(KSCN)是一种用途广泛的化学药品KSCN熔点为172℃,加热至430℃会发生变化,500℃时发生分解。实验室制备硫氰化钾的装置如图所示:

已知:I. 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
II.三颈瓶内盛放: 、水和催化剂;
、水和催化剂;
III. ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解。
在高于170℃时易分解。
(1)制备KSCN溶液
①A装置的作用是_______ 。
②实验过程中待观察到三颈烧瓶中出现_______ 现象时,关闭 ,保持三颈烧瓶内液温105℃一段时间,然后打开
,保持三颈烧瓶内液温105℃一段时间,然后打开 ,继续保持液温105℃一段时间,缓缓滴入适量的KOH溶液,充分反应。打开
,继续保持液温105℃一段时间,缓缓滴入适量的KOH溶液,充分反应。打开 ,继续保持液温105℃一段时间的原因是
,继续保持液温105℃一段时间的原因是_______ 。写出三颈烧瓶中生成KSCN的化学方程式_______ 。
③得到硫氰化钾晶体:_______ 、_______ 、_______ 、过滤,洗涤,减压干燥,得硫氰化钾晶体
(2)性质探究
在试管中依次加入1滴
 溶液、5mL饱和碘水、1滴
溶液、5mL饱和碘水、1滴 溶液,tmin后加入1滴KSCN溶液,溶液变红。甲同学认为是
溶液,tmin后加入1滴KSCN溶液,溶液变红。甲同学认为是 氧化了
氧化了 ,乙同学提出了质疑,认为实验现象不能证明
,乙同学提出了质疑,认为实验现象不能证明 氧化了
氧化了 ,可能是
,可能是 氧化了
氧化了 。请设计实验方案验证乙同学的质疑
。请设计实验方案验证乙同学的质疑_______ 。
(3)上题中涉及的 溶液是由
溶液是由 溶于水得到,实验室常用
溶于水得到,实验室常用 标准溶液测定过二硫酸铵
标准溶液测定过二硫酸铵 的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:
的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为: )。取wg过二硫酸铵样品溶于蒸馏水配制成250mL溶液。准确量取20.00mL配制的溶液于锥形瓶中,用
)。取wg过二硫酸铵样品溶于蒸馏水配制成250mL溶液。准确量取20.00mL配制的溶液于锥形瓶中,用 标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
根据上述数据计算,样品的纯度为_______ (用含w、c的代数式表示,可不化简)。

已知:I.
II.三颈瓶内盛放:
III.
(1)制备KSCN溶液
①A装置的作用是
②实验过程中待观察到三颈烧瓶中出现
③得到硫氰化钾晶体:
(2)性质探究
在试管中依次加入1滴
(3)上题中涉及的
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| II | 1.00 | 23.12 |
| III | 0.00 | 19.92 |
氯化亚铜是一种重要的化工原料,一种利用低品位铜矿(主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等)为原料制取CuCl的工艺流程如图:
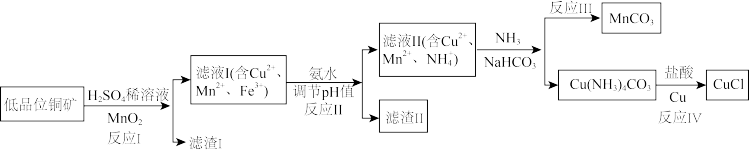
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________ ;
(2)滤渣Ⅰ的成分除S和MnO2外还含有___________ , 反应Ⅰ中MnO2的作用为___________
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是___________ 。
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是___________
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式___________ :②反应Ⅳ所对应的化学方程式:___________
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为___________ %
②误差分析:下列操作会使测定结果偏高的是:___________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出

(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是
(2)滤渣Ⅰ的成分除S和MnO2外还含有
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是
| 物质 | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 8.3 | 1.2 |
| 完全沉淀pH | 6.7 | 9.8 | 3.2 |
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
| 序号 | 1 | 2 | 3 |
| 起始读数/mL | 0.95 | 0.70 | 1.00 |
| 终点读数/mL | 20.95 | 24.95 | 21.00 |
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为
②误差分析:下列操作会使测定结果偏高的是:
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


