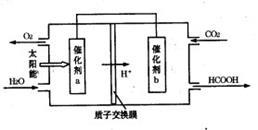
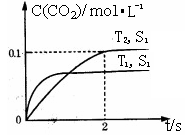填空题 较难0.4 引用1 组卷336
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g) + 6H2(g)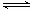 CH3OCH3(g) + 3H2O(g) △H>0。
CH3OCH3(g) + 3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
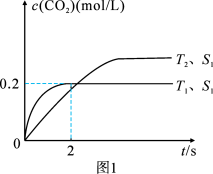
(2)汽车尾气净化的主要原理为:2NO(g) + 2CO (g)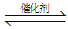 2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
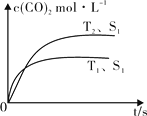
① 该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g) + 2H2(g) CH3OH(g)△H = ﹣a kJ•mol-1。
CH3OH(g)△H = ﹣a kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
则前15分钟,用氢气表示的平均化学反应速率为 ,达到平衡时CO的转化率为 。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g) △H>0。
CH3OCH3(g) + 3H2O(g) △H>0。①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
| A.容器中密度不变 |
| B.单位时间内消耗2molCO2,同时消耗1mol二甲醚 |
| C.v(CO2)︰v(H2)=1︰3 |
| D.容器内压强保持不变 |
(2)汽车尾气净化的主要原理为:2NO(g) + 2CO (g)
 2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
① 该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g) + 2H2(g)
 CH3OH(g)△H = ﹣a kJ•mol-1。
CH3OH(g)△H = ﹣a kJ•mol-1。①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则前15分钟,用氢气表示的平均化学反应速率为 ,达到平衡时CO的转化率为 。
16-17高二上·河南·阶段练习
类题推荐
汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
写出该反应平衡常数表达式:K=_____ 。向一个10L的密闭容器中充入10molCO2和7molH2,830℃时测得H2为lmol,此时V(正)____ V (逆)(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是_______ 。
A.容器中密度不变 B.容器内压强保持不变
C.平均摩尔质量保持不变 D.v(CO2):v(H2)=1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚 F.∆H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
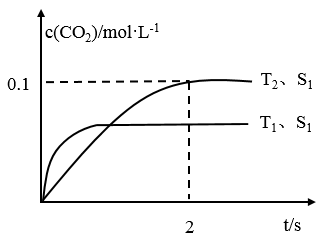
①在T2温度下,0~2 s内的平均反应速率v(N2)=______ ;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线______ 。
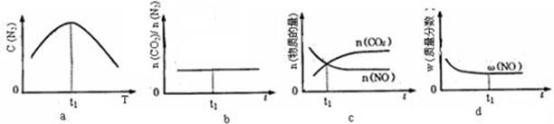
(3)工业上用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)。在容积均为1L的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是__________ 。
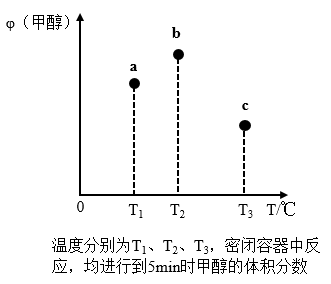
A.正反应的∆H>0
B.反应进行到5min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是
A.容器中密度不变 B.容器内压强保持不变
C.平均摩尔质量保持不变 D.v(CO2):v(H2)=1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚 F.∆H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

①在T2温度下,0~2 s内的平均反应速率v(N2)=
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线
(3)工业上用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)。在容积均为1L的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是

A.正反应的∆H>0
B.反应进行到5min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网