解答题-结构与性质 较难0.4 引用1 组卷318
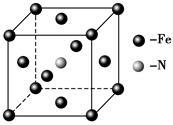
A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为____________ (用元素符号表示),E2+的基态电子排布式为_________ 。
(2)B、D形成的化合物中属于非极性分子的是______ (填化学式),该分子中心原子的杂化类型是_____________ 。
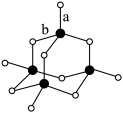
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为___________________ (填图2中字母a或b),1mol该分子中含有的σ键数目为_______ 。
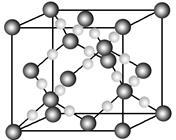
(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为________ 晶体(填晶体类型)。
②E2(CO)8晶体中存在的作用力有______________________ 。
(1)A、C、D的第一电离能由大到小的顺序为
(2)B、D形成的化合物中属于非极性分子的是
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为

(4)E可与CO形成羰基配合物E2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①E2(CO)8为
②E2(CO)8晶体中存在的作用力有
15-16高二下·福建宁德·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网