填空题 适中0.64 引用1 组卷103
(1)甲醇是重要的化工原料,又可做燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -58 kJ/mol
CH3OH(g)+H2O(g) △H2= -58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
回答下列问题:
①△H3=_____ kJ/mol
②25℃,101 kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式_______________
(2)25℃,将a mol·L-1氨水与b mol·L-1盐酸等体积混合后溶液呈中性,则此时溶液中c(NH4+)__________ c(Cl-)(填“>”、“<”或“﹦”);用含a、b的代数式表示该温度下NH3·H2O的电离平衡常数Kb = _________
(3)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
①下图中表示NO2变化的曲线是___________ 用O2表示从0~2s内该反应的平均速率v=____
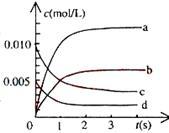
②能说明该反应已经达到平衡状态的是_______
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
①CO(g)+2H2(g)
②CO2(g)+3H2(g)
③CO2(g)+H2(g)
已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
①△H3=
②25℃,101 kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式
(2)25℃,将a mol·L-1氨水与b mol·L-1盐酸等体积混合后溶液呈中性,则此时溶液中c(NH4+)
(3)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①下图中表示NO2变化的曲线是

②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
15-16高二下·河南许昌·阶段练习
类题推荐
I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)⇌CH3OH(g) △H1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
①已知反应①中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H1=
O”表示CO的化学键)数据见表:由此计算△H1=_______ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:_______ 该反应的平衡常数K3=_______ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为_______ 。
Ⅱ。在2L密闭容器中,800℃时反应2NO(g)+O2 (g)⇌2NO2 (g)体系中,n(NO)随时间的变化如表:
(3)如图所示表示NO2变化曲线的是_______ ,用O2表示从0~2 s内该反应的平均速率v=_______ 。
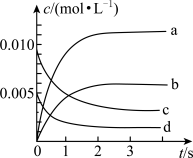
(4)能说明该反应已达到平衡状态的是_______ (填序号)。
a。v(NO2) =2V(O2) b。容器内压强保持不变
c。体系颜色不再改变 d。容器内密度保持不变
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)⇌CH3OH(g) △H1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C
 O”表示CO的化学键)数据见表:由此计算△H1=
O”表示CO的化学键)数据见表:由此计算△H1=②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为
Ⅱ。在2L密闭容器中,800℃时反应2NO(g)+O2 (g)⇌2NO2 (g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是

(4)能说明该反应已达到平衡状态的是
a。v(NO2) =2V(O2) b。容器内压强保持不变
c。体系颜色不再改变 d。容器内密度保持不变
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
由此计算△H1=______ kJ·mol-1(用数值表示),则△H3=______ kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____ (填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________ 。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
①CO(g)+2H2(g)
②CO2(g)+3H2(g)
③CO2(g)+H2(g)
(1)已知相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 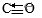 | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2 (g) CH3OH(g) △H1;
CH3OH(g) △H1;
②CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;
③CO2 (g)+H2(g) CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
则x=___________ 。
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而___________ (填“增大”或“减小”),其原因是_____ ;图中的压强由大到小为___________ ,其判断理由是_____________ 。

(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为K1___________ KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是___________ (填序号)。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为____ ,该温度下的平衡常数为___________ ;若容器容积不变,下列措施可增加甲醇产率的是___________ 。(填序号)。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
①CO(g)+2H2 (g)
 CH3OH(g) △H1;
CH3OH(g) △H1;②CO2 (g)+3H2 (g)
 CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;③CO2 (g)+H2(g)
 CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
| 化学键 | H—H | C-O | C≡O | H-O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而

(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为K1
②一定温度下,下列能判断该反应达到化学平衡状态的是
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
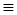 O(CO中的化学键)
O(CO中的化学键)

