解答题-实验探究题 适中0.65 引用2 组卷254
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为:
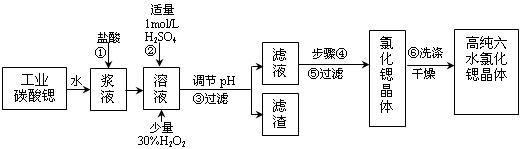
已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是______________________ 。碳酸锶与盐酸反应的化学方程式为______________________ 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________ 。能否用新制氯水代替双氧水__________ (填“能”或“否”)。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至__________ ;宜用的试剂为__________ 。
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是_______________________ (填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是_____________________ 。
(6)步骤⑥中,洗涤氯化锶晶体最好选用_____________ 。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液

已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:

(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为
(3)在步骤②-③的过程中,将溶液的pH值由1调节至
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是
(6)步骤⑥中,洗涤氯化锶晶体最好选用
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
2016·福建厦门·一模
类题推荐
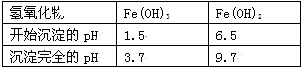
工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和______ (写一种).碳酸锶与盐酸反应的离子方程式______ .
(2)在步骤②-③的过程中,将溶液的pH值由1调节至______ ;宜用的试剂为______ .
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是______ (填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是______
A.50~60℃B.80~100℃C.100℃以上

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①需要加快反应速率,措施有充分搅拌和
(2)在步骤②-③的过程中,将溶液的pH值由1调节至
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是
(4)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃B.80~100℃C.100℃以上
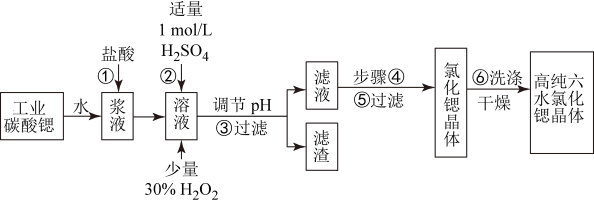
高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有__________(写一种)。操作①中盐酸能否改用硫酸,其理由是:
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________.
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为__________.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是__________ (填化学式).
(5)工业上完成操作③常用的设备有:
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是__________
A.40~50℃ B.50~60℃ C.60~70℃ D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有__________(写一种)。操作①中盐酸能否改用硫酸,其理由是:
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________.
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为__________.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是__________ (填化学式).
(5)工业上完成操作③常用的设备有:
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是__________
A.40~50℃ B.50~60℃ C.60~70℃ D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网