解答题-原理综合题 适中0.65 引用1 组卷322
随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) =" 2HI(g)" + H2SO4(l) ∆H="a" kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) ∆H=" b" kJ/mol ②
2HI(g) = H2(g) + I2(g) ∆H=" c" kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) ∆H=________ kJ/mol
(2)CO2和CH4是两种重要的温室气体,以表面覆盖有Cu2Al2O4的二氧化钛为催化剂。可以将CO2和CH4直接转化为乙酸。
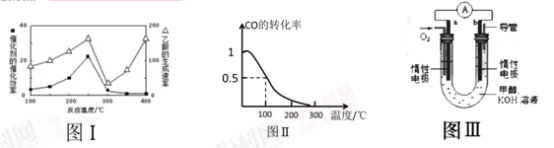
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在_____ ℃左右。
②将Cu2Al2O4溶解在稀硝酸中的离子方程式为________________ 。
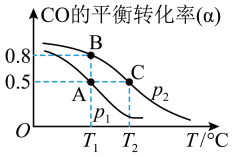
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是___________ (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2,达到新平衡时,CO的转化率_______ (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) CO(g) + 2H2(g) 的平衡常数为
CO(g) + 2H2(g) 的平衡常数为______ (用含有a、V的代数表示)。
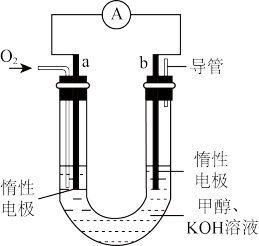
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH-向________ (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为:________________ 。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) =" 2HI(g)" + H2SO4(l) ∆H="a" kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) ∆H=" b" kJ/mol ②
2HI(g) = H2(g) + I2(g) ∆H=" c" kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) ∆H=
(2)CO2和CH4是两种重要的温室气体,以表面覆盖有Cu2Al2O4的二氧化钛为催化剂。可以将CO2和CH4直接转化为乙酸。

①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在
②将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g) + 2H2(g)
 CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:①该反应是
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2,达到新平衡时,CO的转化率
③100℃,反应CH3OH(g)
 CO(g) + 2H2(g) 的平衡常数为
CO(g) + 2H2(g) 的平衡常数为(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH-向
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为:
2016·贵州遵义·二模
类题推荐
对CO2进行综合利用可以节约能源,减少碳排放,对于环保有重要意义。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则估算该反应的△H=________ kJ/mol(用a、b、c、d的代数式表示)。
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为________ mol/L。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2 CH3COOH。
CH3COOH。
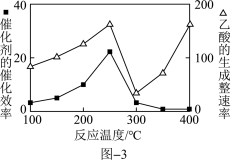
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为________ 。
②为了提高该反应中CH4的转化率,可以采取的措施是________ (写出一种)。
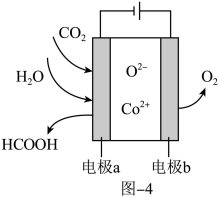
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是________ (填“原电池”或“电解池),电极 的电极反应式为
的电极反应式为________ 。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g) ①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | |
| 键能/(kJ/mol) | a | b | c | d |
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2
 CH3COOH。
CH3COOH。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为
②为了提高该反应中CH4的转化率,可以采取的措施是
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是

二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
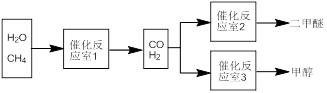
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=
CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________ 。该反应平衡常数的表达式:_____________ 。
(2)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) △H="-1323" KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H="-484" KJ/mol;
CO的燃烧热:283KJ/mol。
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为_______________ 。(本题涉及的条件均在同一条件下)
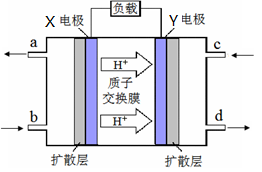
(3) 绿色电源“二甲醚-氧气燃料电池”的工作原理如右图所示,写出X电极的电极反应式_______________
(4)反应室3中在催化剂作用下发生如下反应:CO(g) +2H2(g) CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
①在容积为1L的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图1所示。
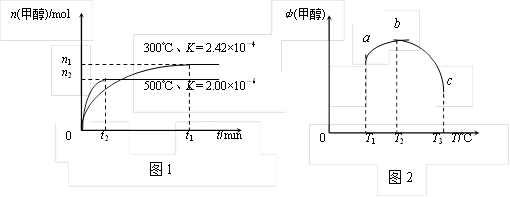
则:该正反应的△H___________ 0(填“<”、“>”或“=")。
②在容积均为1L的a、b、c三个相同密闭容器中分别充入1mol CO和2mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时甲醇的体积分数如图2所示。下列说法正确的是_______________

请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=
CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=(2)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) △H="-1323" KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H="-484" KJ/mol;
CO的燃烧热:283KJ/mol。
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为
(3) 绿色电源“二甲醚-氧气燃料电池”的工作原理如右图所示,写出X电极的电极反应式

(4)反应室3中在催化剂作用下发生如下反应:CO(g) +2H2(g)
 CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:①在容积为1L的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图1所示。

则:该正反应的△H
②在容积均为1L的a、b、c三个相同密闭容器中分别充入1mol CO和2mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时甲醇的体积分数如图2所示。下列说法正确的是
| A.a、b、c三容器5min时的正反应速率大小为:b>a>c |
| B.达到平衡时,a、b、c三容器中CO转化率为a>b>c |
| C.5min时,a、b、c三容器中的反应均可能达到平衡状态。 |
| D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网