解答题-原理综合题 较难0.4 引用1 组卷366
甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)⇌CH3OH(g)的△H═_________ .
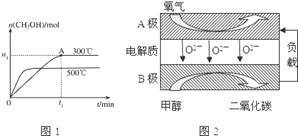
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____ 0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O⇌CO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________ (结果保留小数点后两位数字)
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4mol•L﹣1的草酸钾溶液10ml,能否产生沉淀__________ (填“能”或“否”).
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)⇌CH3OH(g)的△H═
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H
(3)若要提高甲醇的产率,可采取的措施有(填字母)
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |

(4)CH4和H2O在催化剂表面发生反应CH4+H2O⇌CO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4mol•L﹣1的草酸钾溶液10ml,能否产生沉淀
15-16高三下·广西柳州·阶段练习
类题推荐
能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
则 CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=__________ kJ•mol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池______ 极,B极的电极反应式为_________________________________ 。
(3)参考合成反应CO(g)+2H2(g) ⇌CH3OH(g)的平衡常数,回答下列问题:
①该反应正反应是___________ (填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________ ℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
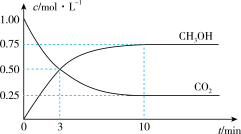
①该反应的平衡常数表达式为K=_______ ;从反应开始到10min,v(H2)=_____ mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是___________ (填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有__ (填字母)
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度_______ (填“>”、“ <”或“=”)0.25mol/L。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g)
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池
(3)参考合成反应CO(g)+2H2(g) ⇌CH3OH(g)的平衡常数,回答下列问题:
| 温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。

①该反应的平衡常数表达式为K=
②下列情况能说明该反应一定达到平衡状态的是
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度
能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
则CO(g)+2H2(g) CH3OH(g)△H=
CH3OH(g)△H=__ kJ•mol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池__ 极,B极的电极反应式为___ 。
(3)参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
①该反应正反应是__ (填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__ ℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。

①该反应的平衡常数表达式为K=__ ;从反应开始到10min,v(H2)=__ mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是__ (填字母)。
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g)
 CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:
CH3OH(g),已知反应中有关物质的化学键键能数据如表所示:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
 CH3OH(g)△H=
CH3OH(g)△H=(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池
(3)参考合成反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:| 温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
①该反应的平衡常数表达式为K=
②下列情况能说明该反应一定达到平衡状态的是
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g)的△H =
CH3OH(g)的△H =
 增大的是
增大的是 =
=

