解答题-无机推断题 适中0.65 引用1 组卷379
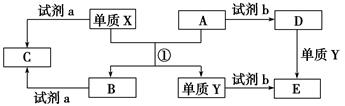
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2)YM2晶体属于___________ 晶体(填晶体类型);30g YM2晶体中含_________ 条共价键(阿伏加德罗常数用NA表示)
(3)在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______ 极,电极反应式为: _______ 。
(4)已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
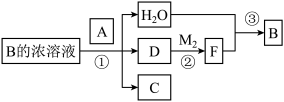
(Ⅰ) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是_____ ;因此反应①的的条件是______ 。在工业上反应③是在__________ (填设备)中进行的;在实验室用________ (填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是_______ ;
(Ⅱ) 按要求写方程式:
写出反应②的化学方程式_____________________________________ ,
写出C与小苏打溶液反应的离子方程式__________________________ ,
(Ⅲ) 若A是元素N的单质写出反应①的化学方程式:_________________ 。
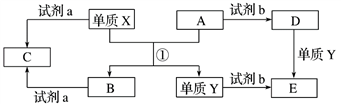
(1)元素X与 M形成X2M2型化合物中阴阳离子个数比为:
(2)YM2晶体属于
(3)在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为
(4)已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:

(Ⅰ) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是
(Ⅱ) 按要求写方程式:
写出反应②的化学方程式
写出C与小苏打溶液反应的离子方程式
(Ⅲ) 若A是元素N的单质写出反应①的化学方程式:
10-11高三上·重庆·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网