解答题-原理综合题 适中0.65 引用1 组卷260
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ/mol
则肼完全燃烧的热化学方程式为________________________________ 。
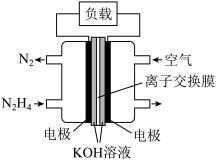
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是____________________ ,电池工作一段时间后,电解质溶液的pH将___________ (填“增大”、“减小”、“不变”)。
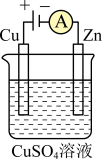
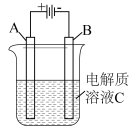
(3)下图是一个电化学装置示意图,用肼—空气燃料电池做此装置的电源。
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是__________ 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗____ mol N2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因_______________ 。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)____ 0.1mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H 、Cl-、OH-、H+离子浓度由大到小的顺序为
、Cl-、OH-、H+离子浓度由大到小的顺序为_______________________________ 。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ/mol
则肼完全燃烧的热化学方程式为
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是
(3)下图是一个电化学装置示意图,用肼—空气燃料电池做此装置的电源。

①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H
10-11高三上·辽宁丹东·阶段练习
类题推荐
纳米级Cu2O由于具有优良的催化性能而倍受关注,下表为制取纳米级Cu2O的三种方法:
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是反应条件不易控制,若控温不当易生成___________ 而使Cu2O产率降低。
(2)已知:2Cu(s)+ O2(g)=Cu2O(s) ΔH=-akJ•mol-1
O2(g)=Cu2O(s) ΔH=-akJ•mol-1
C(s)+ O2(g)=CO(g) ΔH=-bkJ•mol-1
O2(g)=CO(g) ΔH=-bkJ•mol-1
Cu(s)+ O2(g)=CuO(s) ΔH=-ckJ•mol-1
O2(g)=CuO(s) ΔH=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=___________ 。
(3)方法II通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示。
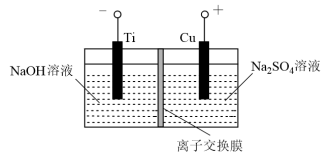
①阴极上的还原产物是___________ 。
②已知阳极生成Cu2O,电极反应式为___________ 。
③Na2SO4溶液的主要作用是___________ 。
(4)方法III是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为___________ 。
(5)肼又称联氨,请写出肼的电子式___________ ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因___________ 。
(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,则溶液中 、Cl-、OH-、H+离子浓度由大到小的顺序为
、Cl-、OH-、H+离子浓度由大到小的顺序为___________ 。
(7)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是___________ ,电池工作一段时间后,电解质溶液的pH将___________ (填“增大”、“减小”、“不变”)。
| 方法I | 用炭粉在高温条件下还原CuO |
| 方法II | 电解法,反应为2Cu+H2O |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是反应条件不易控制,若控温不当易生成
(2)已知:2Cu(s)+
C(s)+
Cu(s)+
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=
(3)方法II通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示。

①阴极上的还原产物是
②已知阳极生成Cu2O,电极反应式为
③Na2SO4溶液的主要作用是
(4)方法III是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为
(5)肼又称联氨,请写出肼的电子式
(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5Cl的水解程度。常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,则溶液中
(7)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网