解答题-工业流程题 适中0.65 引用2 组卷670
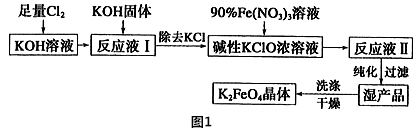
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
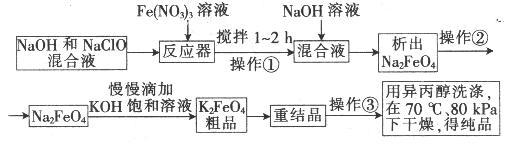
试回答下列问题
(1)操作①搅拌的目的是:_____________________________ 。
(2)操作②与操作③相同,该操作名称是:___________________ 。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为:___________ 。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________ 。(计算结果保留一位小数)
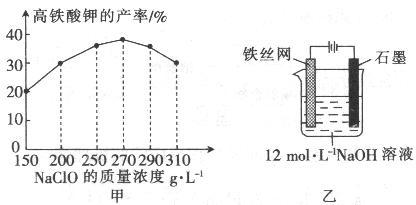
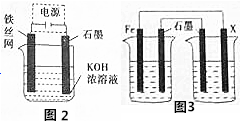
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为____________________ 。

试回答下列问题
(1)操作①搅拌的目的是:
(2)操作②与操作③相同,该操作名称是:
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为:
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为

(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为
10-11高三上·江西吉安·阶段练习
类题推荐
高铁酸盐在能源环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表。所示:
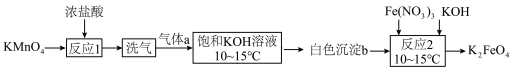
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
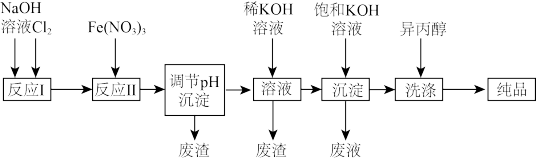
①反应II的离子方程式为___________
②加入饱和KOH溶液的目的是___________
③若加入Fe(NO3)3过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4此反应的离子方程式为___________ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________ 。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为___________ 。
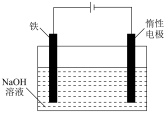
(4)除湿法、干法制备高铁酸盐外,我国学者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的方案,装置如图所示:
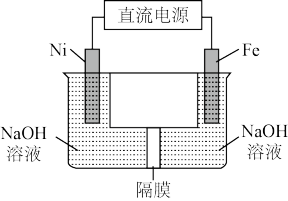
写出Fe电极的电极反应式:___________ 。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应II的离子方程式为
②加入饱和KOH溶液的目的是
③若加入Fe(NO3)3过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4此反应的离子方程式为
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为
(4)除湿法、干法制备高铁酸盐外,我国学者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的方案,装置如图所示:

写出Fe电极的电极反应式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网