解答题-原理综合题 较难0.4 引用1 组卷334
在一定条件下,CO2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
已知:
该反应△H=________ KJ/mol。
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
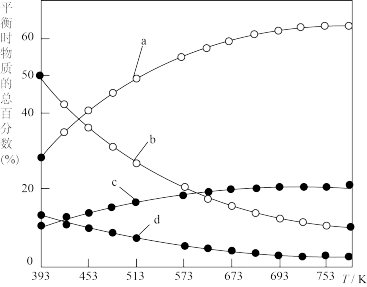
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=________ ;
②曲线a表示的物质为H2,理由是________ ;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________ (列举2项).
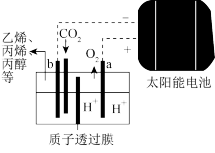
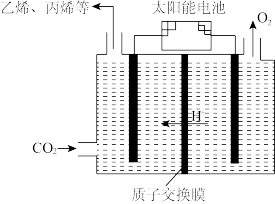
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________ 。
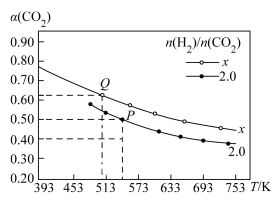
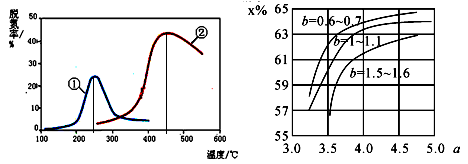
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
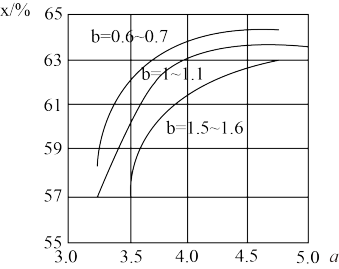
①b宜控制在________ (填序号)范围内
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是________ 。
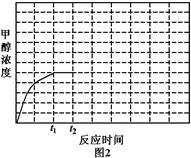
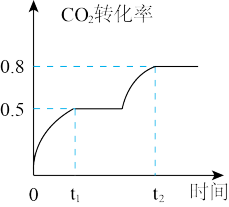
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g) CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________ " mL。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g)
已知:
| 共价键 | C=O | H—H | C—O | C—H | O—H |
| 键能(KJ·mol-1) | 750 | 436 | 358 | 413 | 463 |
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)

①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
②曲线a表示的物质为H2,理由是
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式

(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2

①b宜控制在
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)

15-16高三下·福建厦门·阶段练习
类题推荐
氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗做各种有益的探究; 氨在工业上有广泛用途。
(1)合成氨用的 H2 可以 CH4 为原料制得。已知相关的化学键键能数据如下:
则 CH4(g)与 H2O(g)反应生成 CO(g)和 H2(g)的热化学方程式____ 。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了 较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是_____ 。
(3)在 425℃、A12O3 作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH 显弱碱性,与盐酸反应 生成(CH3)2NH2Cl ,溶液中各离子浓度由小到大的顺序为___ 。
(4)直接供氨式碱性燃料电池的电池反应式 4NH3 + 3O2 = 2N2+ 6H2O,负极电极反应式为_____ 。
(5)如下图,采用 NH3 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含 量,从而确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也 可以表示平衡常数(记作 KP),则上述反应的 KP=_______ 。
②以下说法正确的是________ 。
A.上述反应的正反应为吸热反应。
B.相同条件下,改变压强对脱氮率没有影响。
C.催化剂①、②分别适合于 250℃和 450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在
CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________ (填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a 宜控制在 4.0 左右,理由是___________ 。
(7)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO 和 NO2)。尾气中的 NO、NO2 与 水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化 物(假设 NO、NO2 体积比为 1:1)的质量为________ g。
(1)合成氨用的 H2 可以 CH4 为原料制得。已知相关的化学键键能数据如下:
| 化学键 | H-H | C-O | H-O | C-H | |
| E/(Kj. | 436 | 351 | 1076 | 463 | 413 |
则 CH4(g)与 H2O(g)反应生成 CO(g)和 H2(g)的热化学方程式
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了 较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是
(3)在 425℃、A12O3 作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH 显弱碱性,与盐酸反应 生成(CH3)2NH2Cl ,溶液中各离子浓度由小到大的顺序为
(4)直接供氨式碱性燃料电池的电池反应式 4NH3 + 3O2 = 2N2+ 6H2O,负极电极反应式为
(5)如下图,采用 NH3 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含 量,从而确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g)

①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也 可以表示平衡常数(记作 KP),则上述反应的 KP=
②以下说法正确的是
A.上述反应的正反应为吸热反应。
B.相同条件下,改变压强对脱氮率没有影响。
C.催化剂①、②分别适合于 250℃和 450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a 宜控制在 4.0 左右,理由是
(7)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO 和 NO2)。尾气中的 NO、NO2 与 水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化 物(假设 NO、NO2 体积比为 1:1)的质量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网