解答题-实验探究题 适中0.65 引用1 组卷212
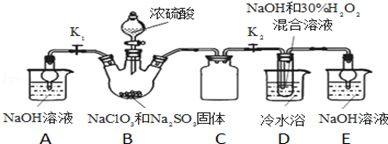
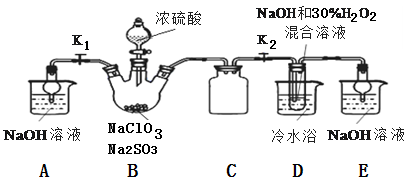
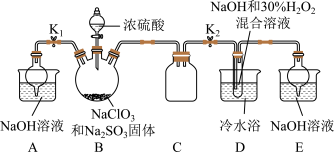
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。某化学探究小组开展如下图所示实验制取NaClO2晶体并测定其纯度。回答下列问题
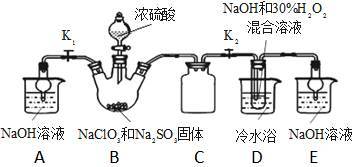
(1)用50%双氧水配置30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____________ (填仪器名称);右下图装置C的作用是_____________ 。
(2)装置D中反应生成NaClO2的化学方程式为_____________ 。反应后溶液中阴离子除ClO2、ClO3、Cl、ClO、OH外还可能含有一种阴离子是_____________ ,检验该离子的方法是_____________ 。产生该离子最可能的的原因是_________ 。
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸进入到D装置内
(3)请补充从反应后的溶液中获得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③______ ;④_________ ;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是____________ 。
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-。将所得混合液体稀释成100ml待测溶液。取25.00ml待测溶液,加入淀粉溶液做指示剂,用c mol·L-1NaS2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V ml(已知:I2+2S2O32-=2I-+S4O42-)
①确认滴定终点的现象是__________
②所称取的样品中NaClO2的物质的量为____________ (用含C、V的代数式表示)。

(1)用50%双氧水配置30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要
(2)装置D中反应生成NaClO2的化学方程式为
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸进入到D装置内
(3)请补充从反应后的溶液中获得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-。将所得混合液体稀释成100ml待测溶液。取25.00ml待测溶液,加入淀粉溶液做指示剂,用c mol·L-1NaS2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V ml(已知:I2+2S2O32-=2I-+S4O42-)
①确认滴定终点的现象是
②所称取的样品中NaClO2的物质的量为
2016·河南商丘·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网