解答题-原理综合题 适中0.65 引用1 组卷256
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl =2 MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为_________ 。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为_________ (填化学式)。[已知Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
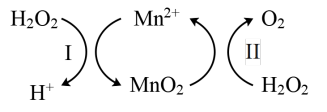
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
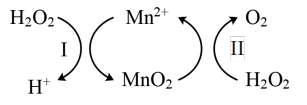
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+ ( aq)=Mn2+ (aq) +O2(g)+2H2O(1) △H2。写出反应 I的热化学方程式(焓变用△H1和△H2表示):_________ 。
②某温度时,向10 mL0.4 mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:
0~2 min时反应速率比2~4 min时的快,其原因是______________ ,0~6 min的平均反应速率v(H2O2)=_________ (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:
①反应I的正反应是_________ (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为_________ 。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl =2 MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:

①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+ ( aq)=Mn2+ (aq) +O2(g)+2H2O(1) △H2。写出反应 I的热化学方程式(焓变用△H1和△H2表示):
②某温度时,向10 mL0.4 mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:
反 应 | 平衡常数Kp | |
| 773K | 873K | |
| Ⅰ.CO2(g)+4H2(g) | 19.4 | 0.803 |
| Ⅱ. CO2(g)+3H2(g) | 6.07 | 3.65 |
②反应Ⅱ的平衡常数表达式为
15-16高三下·山西临汾·阶段练习
类题推荐
一定温度下,向10mL0.40mol·L-1的H2O2溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
资料显示,反应分两步:①2Fe3++H2O2=2Fe2++2H++O2↑;
②H2O2+2Fe2++2H+=2H2O+2Fe3+。
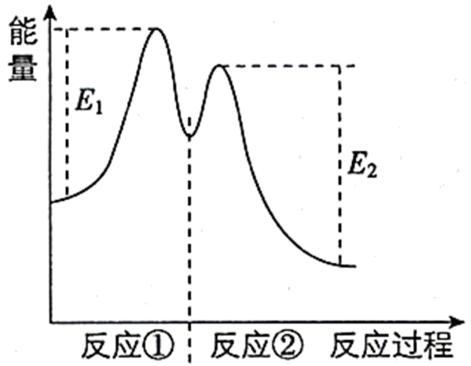
反应过程中能量变化如图所示。下列说法正确的是
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
②H2O2+2Fe2++2H+=2H2O+2Fe3+。
反应过程中能量变化如图所示。下列说法正确的是

| A.Fe2+也是反应的催化剂 |
| B.反应①②均是放热反应 |
| C.反应2H2O2(aq)=2H2O(1)+O2(g)是吸热反应 |
| D.0~6min内的平均反应速率v(H2O2)≈3.33×10-2mol·L-1·min-1 |
H2O2是一种“绿色”试剂,应用于多个领域。回答下列问题:
(l)H2O2分子中__________ (填字母)。
a.含有离子键 b.只含极性共价键 c.只含非极性共价键 d.既含有极性共价键又含有非极性共价键
(2)若向2mL30%的H2O2溶液中通入SO2,反应后的溶液中滴入BaCl2溶液,发现有白色沉淀,则说明H2O2具有_____ (填“氧化性”或“还原性”),写出H2O2与SO2反应的化学方程式:_____ 。
(3)实验发现,向20mL0.40mol•L-1H2O2溶液中加入少量KI溶液可以加快其分解速率。有人提出反应机理可能有2步:i.H2O2+I-=H2O+IO-,ii.H2O2+IO-=H2O+O2↑+I-。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下:
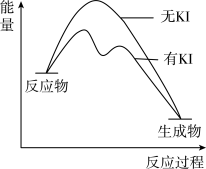
①KI________ (填“能”或“不能”)影响H2O2分解反应的能量变化。
②反应i是________ (填“吸热”或“放热”,下同)反应,反应ii是________ 反应。
③若不考虑溶液体积变化,则0~10min的平均反应速率:v(H2O2)=_________ mol·L-1·min-1。
(l)H2O2分子中
a.含有离子键 b.只含极性共价键 c.只含非极性共价键 d.既含有极性共价键又含有非极性共价键
(2)若向2mL30%的H2O2溶液中通入SO2,反应后的溶液中滴入BaCl2溶液,发现有白色沉淀,则说明H2O2具有
(3)实验发现,向20mL0.40mol•L-1H2O2溶液中加入少量KI溶液可以加快其分解速率。有人提出反应机理可能有2步:i.H2O2+I-=H2O+IO-,ii.H2O2+IO-=H2O+O2↑+I-。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下:

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
①KI
②反应i是
③若不考虑溶液体积变化,则0~10min的平均反应速率:v(H2O2)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=
CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=