解答题-实验探究题 较难0.4 引用3 组卷550
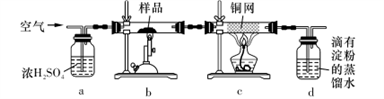
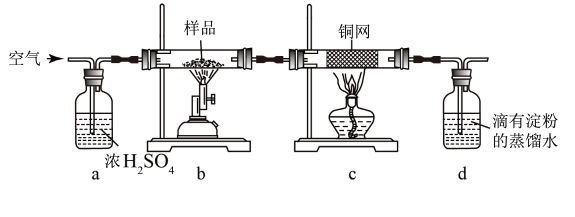
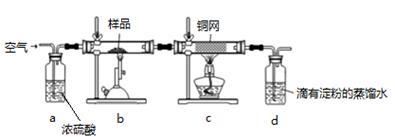
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
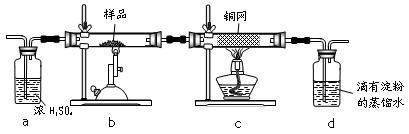
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的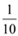 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:

(1)称量样品所用的仪器为_____ ,将样品研细后再反应,其目的是_______ 。
(2)装置a的作用是________ 。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________ 。
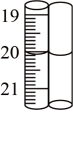
(4)滴定时,标准碘溶液所耗体积为_________ mL。判断滴定已达终点的现象是_______ 。通过计算可知,该黄铜矿的纯度为________ 。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____ 。(填编号)
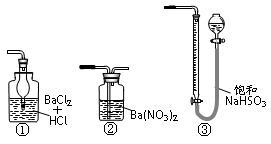
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有____________________ 。

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
(1)称量样品所用的仪器为
(2)装置a的作用是
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
(4)滴定时,标准碘溶液所耗体积为
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是

(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有
2010·江苏南通·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
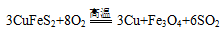
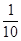 置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:

