填空题 适中0.65 引用2 组卷561
一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:
FeO(s)+CO(g)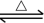 Fe(s)+CO2(g) △H=-1kJ/mol。
Fe(s)+CO2(g) △H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将______
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应_______ .
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)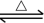 CO2(g)+H2(g) K=1.0
CO2(g)+H2(g) K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为_______ 。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH3
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52tCO最多可制得甲酸甲醛多少吨?(写出计算过程)。_______
(1)高炉炼铁中发生的反应之一是:
FeO(s)+CO(g)
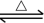 Fe(s)+CO2(g) △H=-1kJ/mol。
Fe(s)+CO2(g) △H=-1kJ/mol。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)
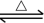 CO2(g)+H2(g) K=1.0
CO2(g)+H2(g) K=1.0若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH3
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52tCO最多可制得甲酸甲醛多少吨?(写出计算过程)。
2010·江苏南京·三模
类题推荐
(1)已知下列热化学方程式:
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式______________ 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
①比较K1、K2的大小,K1__________ K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是_________ (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度______ (填“增大”或“减小”或“不变”,下同),NH3的体积分数__________ 。
(3)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
①其平衡常数可表示为_____________ 。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为_________ (用百分数表示),该反应是否处于化学平衡状态____ (选填“是”或“否”),此时,化学反应速率是υ正____ υ逆(选填“大于”、“小于”或“等于”)。
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
| t/K | 298 | 398 | 498 |
| K/(mol/L)-2 | 4.1×106 | K1 | K2 |
①比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度
(3)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)
①其平衡常数可表示为
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为
回答下列问题:
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=________ 。
(2)该反应为________ 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________ 。
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为_______ ℃。
Ⅱ.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0,其平衡常数K=
Fe(s)+CO2(g) △H>0,其平衡常数K= ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。
(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值_______ (填“增大”、“减小”或“不变”):平衡常数K值________ (填“增大”、“减小”或“不变”)。
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态______ (填“是”或“否”),此时v正______ v逆(填“>”或“=”或“<”)。
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
Ⅱ.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)
(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0

