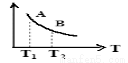解答题-原理综合题 适中0.65 引用2 组卷439
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______ ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,则在电化学合成氨的过程中,阴极反应式为
2NH3,则在电化学合成氨的过程中,阴极反应式为__________________________________________ ;
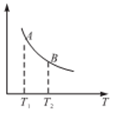
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为______ ;
②右图中在状态A时,平衡常数KA____________ (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时, KA ____ KB(填“>”、“<”或“=”)。

③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
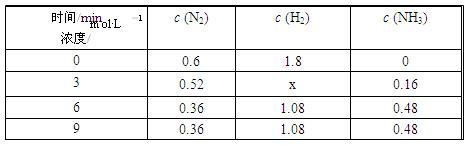
反应从0 min到3 min之间,H2的反应速率为______________ ;反应在3 min时,条件发生了改变,改变的条件可能是________ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2
 2NH3,则在电化学合成氨的过程中,阴极反应式为
2NH3,则在电化学合成氨的过程中,阴极反应式为(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为
②右图中在状态A时,平衡常数KA

③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

反应从0 min到3 min之间,H2的反应速率为
a.使用催化剂 b.降低温度 c.增加H2的浓度
2010·山东青岛·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
2Fe(s) + 3CO(g) +6H2(g) ⊿H>0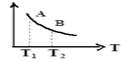
 2NH3,该过程中还原反应的方程式为
2NH3,该过程中还原反应的方程式为
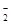 )>c(OH
)>c(OH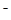 )> c(H+)
)> c(H+)