解答题-原理综合题 适中0.65 引用3 组卷309
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
①CH3OH(g) CO(g)+2H2(g) △H1=+90.8kJ/mol
CO(g)+2H2(g) △H1=+90.8kJ/mol
②CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H2=+49kJ/mol
CO2(g)+3H2(g) △H2=+49kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
回答下列问题:
(1)△H3=__________ ;
(2)根据化学原理分析升高温度对反应②的影响__________ ;
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2。
①电解时,阳极的电极反应式为__________ ;
②Co3+氧化CH3OH的离子方程式为__________ 。
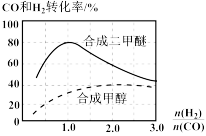
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[ ]的变化如图所示:
]的变化如图所示:
合成二甲醚的最佳氢碳比为__________ ,对于气相反应,用某组分(B)的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),水煤气合成二甲醚的反应的平衡常数表达式为KP=__________ 。
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△Hθ表示。已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ•mol-1和—283.0 kJ •mol-1,则CO2(g)、CO(g)的△Hθ分别为__________ 、__________ 。
①CH3OH(g)
②CH3OH(g)+H2O(g)
③CO(g)+H2O(g)
回答下列问题:
(1)△H3=
(2)根据化学原理分析升高温度对反应②的影响
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2。
①电解时,阳极的电极反应式为
②Co3+氧化CH3OH的离子方程式为
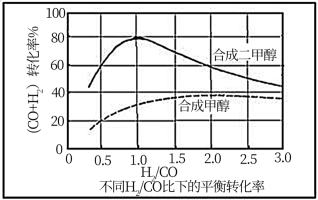
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[

合成二甲醚的最佳氢碳比为
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△Hθ表示。已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ•mol-1和—283.0 kJ •mol-1,则CO2(g)、CO(g)的△Hθ分别为
15-16高三下·江苏·阶段练习
类题推荐
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g) 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g) CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g) 2NO(g) △H=
2NO(g) △H= ____________ kJ/mol
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
则C2较合理的数值为_________ (填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g) CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
若a=2,b=1,则c=____ ,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比 的变化如图所示:
的变化如图所示:
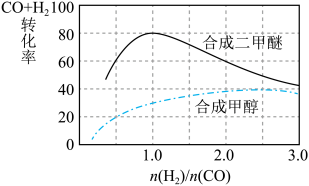
①合成二甲醚的最佳氢碳比为__________ 。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为________________ 。
(1)已知:2NO(g)+2CO(g)
2C(s)+O2(g)
C(s)+O2(g)
则N2(g)+O2(g)
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g)
 CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | C | d | 1 |
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)

①合成二甲醚的最佳氢碳比为
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网