解答题-无机推断题 较难0.4 引用1 组卷210
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________ 。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________ 。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________ ,从原子结构的角度解释不存在RCl5分子的原因_______ 。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________ 。
②甲→乙的化学方程式为______________ 。
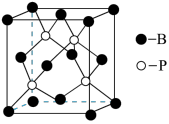
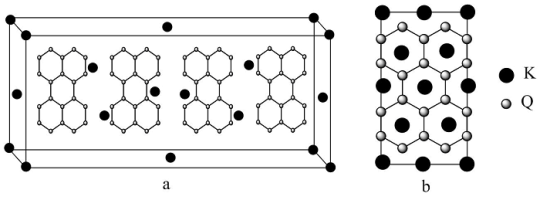
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________ 。
(1)Z原子的价电子排布式为
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为
②甲→乙的化学方程式为
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为

15-16高二上·福建厦门·期末
类题推荐
已知X、Y、Z、Q、R、E 六种前四周期元素中,原子序数依次增大,其结构或性质如信息如下表。
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:______ 。X的一种氢化物相对分子质量为26,其中X的杂化方式为_____ 。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)_______ 。
(3)X、Z元素分别与氢元素形成的最简单化合中物,沸点较高的为(写化学式)___ ,原因是___ 。
(4)XZ与Y2属于等电子体.写出化合物XZ的电子式:_____ 。
(5)R的一种配合物的化学式为RCl3•6H2O。已知0.01 mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是_________ 。
A. [R(H2O)6]Cl3 B. [R(H2O)5Cl]Cl2•H2O C. [R(H2O)4Cl2]Cl•2H2O D. [R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到天蓝色溶液,写出沉淀溶解反应的离子方程式为:_______ 。
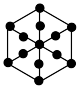
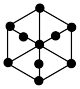
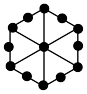
(7)元素E的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
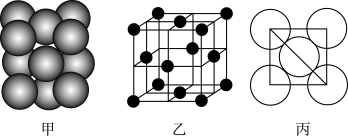
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加 德罗常数的值,则该晶体的密度为______ g•cm-3(用字母表示)。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)
(3)X、Z元素分别与氢元素形成的最简单化合中物,沸点较高的为(写化学式)
(4)XZ与Y2属于等电子体.写出化合物XZ的电子式:
(5)R的一种配合物的化学式为RCl3•6H2O。已知0.01 mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是
A. [R(H2O)6]Cl3 B. [R(H2O)5Cl]Cl2•H2O C. [R(H2O)4Cl2]Cl•2H2O D. [R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到天蓝色溶液,写出沉淀溶解反应的离子方程式为:
(7)元素E的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加 德罗常数的值,则该晶体的密度为
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:_______________ 。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为_________ 。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)_________ 。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)_________ ,原因是_______________ 。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:_______________ 。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:_______________ ,继续滴加氨水至过量,沉淀溶解,得到天蓝色溶液,写反应的离子方程式为:_________ 。
(7)元素E的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
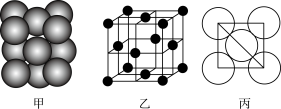
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏伽德罗常数,则该晶体的密度为___________ g·cm-3(用字母表示)。
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
| A.[R(H2O)6]Cl3 | B.[R(H2O)5Cl]Cl2·H2O |
| C.[R(H2O)4Cl2]Cl·2H2O | D.[R(H2O)3Cl3]·3H2O |
(7)元素E的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏伽德罗常数,则该晶体的密度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网