填空题 适中0.65 引用6 组卷656
经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
(1)c(H+)=___________ mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
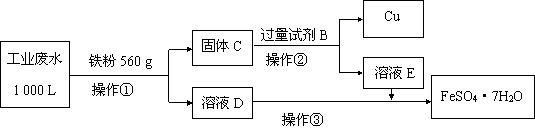
① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+= Fe2++ Cu、____________ 、____________ 。
② 试剂B是__________ 。
③ 操作③是蒸发浓缩、冷却结晶、___________ ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是____________ 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________ 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是________ mol。
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+= Fe2++ Cu、
② 试剂B是
③ 操作③是蒸发浓缩、冷却结晶、
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是
⑤ 获得的FeSO4·7H2O需密闭保存,原因是
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是
15-16高一上·北京朝阳·期末
类题推荐
经检测某工厂的酸性废水中所含离子及其浓度如表所示:
(1)
___________  。
。
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾 。
。

①工业废水中加入铁粉生成固体C的离子方程为:___________ 。
②试剂B的化学式是___________ 。
③通过检验溶液D,来判断废水中 是否除尽,实验方法是
是否除尽,实验方法是___________ 。
④上述 废水经处理,可获得
废水经处理,可获得 的物质的量是
的物质的量是___________  。
。
⑤在含有 的溶液中加入
的溶液中加入 现象是
现象是___________ ;已知反应物恰好完全反应且反应转移 电子,生成的气体标况下的体积为
电子,生成的气体标况下的体积为___________ L。
| 离子 | Fe3+ | Cu2+ | Na+ | H+ | |
| 浓度/(mol/L) |
(1)
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾

①工业废水中加入铁粉生成固体C的离子方程为:
②试剂B的化学式是
③通过检验溶液D,来判断废水中
④上述
⑤在含有
经检测某工厂的酸性废水中所含离子及其浓度如表所示:
(1)c(H+)=_____ mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。

①工业废水中加入足量铁粉充分反应后过滤得到溶液D,通过检验溶液D中只含有Fe2+,检验Fe2+操作方法是_____ 。
②操作③是______ 。
③上述100L废水经处理,可获得FeSO4·7H2O的物质的量是______ mol。
④在含有4molFeSO4的溶液中加入4molNa2O2恰好完全反应且反应转移6mol电子,在反应中,既有沉淀生成,又有气体放出,则发生反应的总的离子方程式为:_______ 。
| 离子 | Fe3+ | Cu2+ | SO | Na+ | H+ |
| 浓度/(mol/L) | 2×10-2 | 1×10-2 | 1×10-1 | 2×10-2 |
(2)为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。

①工业废水中加入足量铁粉充分反应后过滤得到溶液D,通过检验溶液D中只含有Fe2+,检验Fe2+操作方法是
②操作③是
③上述100L废水经处理,可获得FeSO4·7H2O的物质的量是
④在含有4molFeSO4的溶液中加入4molNa2O2恰好完全反应且反应转移6mol电子,在反应中,既有沉淀生成,又有气体放出,则发生反应的总的离子方程式为:
经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
(1)c(H+)=___________ mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
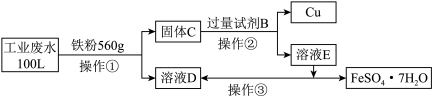
①工业废水中加入铁粉后,反应的离子方程式为:___________ 。
②试剂B的化学式是___________ 。
③加入铁粉后判断废水中Fe3+是否除尽的方法是___________ 。
④上述100L废水经处理,可获得FeSO4·7H2O的物质的量是___________ mol。
⑤由制得的绿矾晶体配制50mL1mol/LFeSO4溶液时,以下实验操作会导致所配溶液浓度偏高的是___________ 。
A.用托盘天平称量绿矾晶体时,用到游码,且将砝码放在左盘,药品放在右盘
B.转移时,有液体溅出
C.最后一次转移后,发现液体超过刻度线,倒出多余部分
D.定容时,俯视刻度线
| 离子 | Fe3+ | Cu2+ | Na+ | H+ | |
| 浓度/(mol/L) | 2×10-2 | 1×10-2 | 1×10-1 | 2×10-2 |
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

①工业废水中加入铁粉后,反应的离子方程式为:
②试剂B的化学式是
③加入铁粉后判断废水中Fe3+是否除尽的方法是
④上述100L废水经处理,可获得FeSO4·7H2O的物质的量是
⑤由制得的绿矾晶体配制50mL1mol/LFeSO4溶液时,以下实验操作会导致所配溶液浓度偏高的是
A.用托盘天平称量绿矾晶体时,用到游码,且将砝码放在左盘,药品放在右盘
B.转移时,有液体溅出
C.最后一次转移后,发现液体超过刻度线,倒出多余部分
D.定容时,俯视刻度线
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


