解答题-原理综合题 适中0.65 引用1 组卷334
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
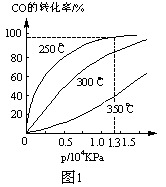
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
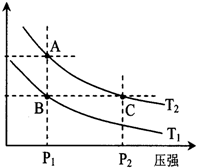
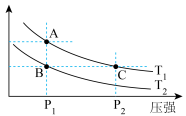
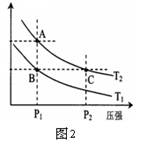
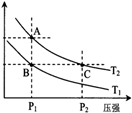
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
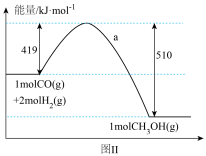
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
 CH3OH(g)
CH3OH(g)(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
15-16高二上·四川成都·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网