解答题-原理综合题 适中0.65 引用1 组卷153
(1)钠及其化合物是中学化学常用物质,核潜艇或宇宙飞船常用过氧化钠做供氧剂,其原理是
(2)下列关于Na2O2的叙述正确的是
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,该物质可能是C6H12O6
D.Na2O2的漂白原理与SO2的漂白原理相同
E.Na2O2与水反应是水作还原剂的氧化还原反应
F.Na2O2与NaHCO3固体按物质的量之比1:1混合加热充分反应后,所得固体中Na2CO3和NaOH的物质的量之比亦为1:1
(二)切开的金属Na暴露在空气中,其变化过程如下:

(3)反应Ⅰ的反应过程与能量变化的关系如右图:

① 反应Ⅰ 是
②1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是
(4)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (
C.加入少量NaOH固体,c (
D.c(Na+)> c(
(5)钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na
16-17高三上·山东潍坊·阶段练习
类题推荐
研究SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,用Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
①由上表判断,NaHSO3溶液显____________ 性,用平衡原理解释:_____________________ ;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)___________________ ;
a.c(Na+)=2c(SO )+c(HSO
)+c(HSO )
)
b.c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(2)若某溶液中含3mol Na2SO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HSO 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________ mol;
(3)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为
CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为___________ ,再加入1.0molCO后重新达到平衡,则CO的转化率__________ (填“增大”、“不变”或“减小”),CH3OH的体积分数___________ (填“增大”、“不变”或“减小”);
(4)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为___________________ 。(已知Ksp(BaSO4)=1.1×10-10)
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟上述过程,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化(Co3+的还原产物是Co2+)。

① 写出阳极电极反应式:________________________ ;
② 写出除去水中的甲醇的离子方程式:________________________ 。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,用Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:n(SO )∶n(HSO )∶n(HSO ) ) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)
a.c(Na+)=2c(SO
 )+c(HSO
)+c(HSO )
)b.c(Na+)>c(HSO
 )>c(SO
)>c(SO )>c(H+)=c(OH-)
)>c(H+)=c(OH-)c.c(Na+)+c(H+)=c(SO
 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)(2)若某溶液中含3mol Na2SO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HSO
 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于(3)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)
(4)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟上述过程,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化(Co3+的还原产物是Co2+)。

① 写出阳极电极反应式:
② 写出除去水中的甲醇的离子方程式:
I.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1="a" kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H2="b" kJ/mol
2CO(g)+O2(g) =2CO2(g) △H3="c" kJ/mol
(1)求反应CH4(g)+CO2(g) =2CO(g)+2H2(g) △H=____ kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为________ 。
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2(g)+CH4(g) =CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:

①250~300℃时,乙酸的生成速率降低的原因是____________ 。
②300~400℃时,乙酸的生成速率升高的原因是___________ 。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX 2Na+xS (3<x<5)
2Na+xS (3<x<5)

(4)根据上表数据,判断该电池工作的适宜温度应为____ (填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是____ (填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为___ mol,两极的反应物的质量差为____ g。(假设电解前两极的反应物的质量相等)
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1="a" kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H2="b" kJ/mol
2CO(g)+O2(g) =2CO2(g) △H3="c" kJ/mol
(1)求反应CH4(g)+CO2(g) =2CO(g)+2H2(g) △H=
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2(g)+CH4(g) =CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:

①250~300℃时,乙酸的生成速率降低的原因是
②300~400℃时,乙酸的生成速率升高的原因是
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |

(4)根据上表数据,判断该电池工作的适宜温度应为
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为
室温下,0.25molC2H4(g)完全燃烧生成二氧化碳和液态水,放出352.75kJ的热量。请写出该反应的热化学方程式:_________________ 。为了缓解温空效应,科学家提出了多种回收和利用CO2的方案。
方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = + 113. 4kJ/mol
(1) 3FeO(g)+H2O(g)= Fe3O4(s)+H2(g) ΔH3 =__________
(2) 在反应i中,每放出38.0kJ热量有____________ gFeO被氧化。
室温下,物质的量浓度均为0.lmol/L 的几种盐溶液的pH如下表:
(3)写出溶液④中通入少量CO2的离子方程式:__________
(4)25℃时,溶液①中,由水电离产生的c(OH-)=_____ mol/L。
(5)下列说法正确的是__________ (填序号)。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol/L
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
方案2:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应:CO2(g)+4H2(g) CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。

(6)①从反应开始到恰好达到平衡时,H的平均反应速率v(H2)=____________ 。
②300℃时,反应的平衡常数K=____________ 。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度__ (填序号)。
A.等于0.8mo/L B.等于1.6mo/L
C.0.8mol/L4)<1.6mol/L D.大于1.6mol/L
(7)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g).则v正___ v逆
(填“>”“<”或“=" )。
(8)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则ΔH4____ 0(填“>”“<”或“=”)。
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
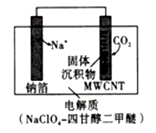
(9)①放电时,正极的电极反应式为____________ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为___ g。
方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = + 113. 4kJ/mol
(1) 3FeO(g)+H2O(g)= Fe3O4(s)+H2(g) ΔH3 =
(2) 在反应i中,每放出38.0kJ热量有
室温下,物质的量浓度均为0.lmol/L 的几种盐溶液的pH如下表:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
| pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(3)写出溶液④中通入少量CO2的离子方程式:
(4)25℃时,溶液①中,由水电离产生的c(OH-)=
(5)下列说法正确的是
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol/L
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
方案2:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应:CO2(g)+4H2(g)
 CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
(6)①从反应开始到恰好达到平衡时,H的平均反应速率v(H2)=
②300℃时,反应的平衡常数K=
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度
A.等于0.8mo/L B.等于1.6mo/L
C.0.8mol/L4)<1.6mol/L D.大于1.6mol/L
(7)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g).则v正
(填“>”“<”或“=" )。
(8)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则ΔH4
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
(9)①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


