解答题-原理综合题 困难0.15 引用1 组卷412
炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
①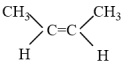 (g)+H2(g)
(g)+H2(g) CH3CH2CH2CH3(g) △H1
CH3CH2CH2CH3(g) △H1
②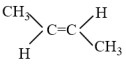 (g)+H2(g)
(g)+H2(g) CH3CH2CH2CH3(g) △H2
CH3CH2CH2CH3(g) △H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____ ;
A.△H1>0;△H2<0
B.反应①、反应②都是丁烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______ (用△H1、△H2表示)
 (g)
(g)  (g)
(g) 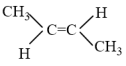 △H
△H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:
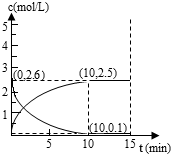
①前10分钟,平均反应速率v(H2)为______ mol·L-1·min-1
②该温度下,此反应平衡常数K=_______ (平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丙烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________ 。
①
 (g)+H2(g)
(g)+H2(g)②
 (g)+H2(g)
(g)+H2(g)(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是
| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
B.反应①、反应②都是丁烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=
 (g)
(g)  (g)
(g)  △H
△H(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为
②该温度下,此反应平衡常数K=
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+
②CH3CH2CH3(g)+5O2(g)
丙烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g)
则表示CH3CH=CH2标准燃烧热的热化学方程式为
15-16高二上·海南·阶段练习
类题推荐
I.已知:CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.2kJ·mol-1 K1
CO(g)+H2O(g) △H1=+41.2kJ·mol-1 K1
CO(g)+2H2(g) CH3OH(g) △H2=-90.6kJ·mol-1 K2
CH3OH(g) △H2=-90.6kJ·mol-1 K2
则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为_______ ,该反应的化学平衡常数K3=_______ 。(用K1,K2表示)
II.已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的△H=_______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1。则A的平均反应速率v(A)=_______ 。该反应达到平衡时A的转化率为 _______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率 _______ (填”变大“、”变小“或”不变“)
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正_______ v逆(填”大于“、”小于“或”等于“)。
CO(g)+2H2(g)
则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为
II.已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的△H=
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1。则A的平均反应速率v(A)=
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正
I.已知:CO2(g)+H2(g) CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1
CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1
CO(g)+2H2(g) CH3OH(g)△H2=-90.6kJ·mol-1K2
CH3OH(g)△H2=-90.6kJ·mol-1K2
则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为______ ,该反应的化学平衡常数K3=_____ 。(用K1,K2表示)CH3OH(g)燃料电池在碱性条件(KOH溶液)下的负极反应式为__________ ,正极反应式为___ 。
II.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的△H=______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=______ 。该反应达到平衡时A的转化率为______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率____ (填”变大“、”变小“或”不变“)
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40molB、0.40molC和0.50molD,此时v正______ v逆(填”大于“、”小于“或”等于“)。
CO(g)+2H2(g)
则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为
II.已知A(g)+B(g)
| 温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
(1)该反应的△H=
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40molB、0.40molC和0.50molD,此时v正
(1)25 ℃时,制备四氯化硅相关的热化学方程式和平衡常数如表:
则该温度下,ΔH3=_______ kJ∙mol-1;K3=_______ (用K1和K2表示)。
(2)25℃时,在体积为1L的恒容密闭容器中通入0.8 mol NO和0.4 molCl2发生如下反应2NO(g)+Cl2(g)⇌2NOCl(g)。
①若温度恒定,反应过程中压强(p)随时间(t)的变化如图实线所示,则ΔH_______ (填">""<"或"=")0;
②若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图虚线所示,则改变的条件是_______ ;
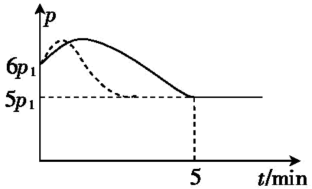
③在5 min时,再充入0.8 mol NO和0.4 molCl2,再次平衡后则NO的转化率_______ (填"增大"、"减小"或"不变")。
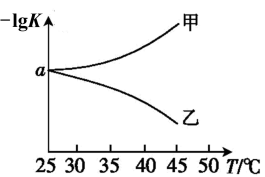
④如图是甲、乙两同学描绘上述反应的平衡常数的负对数值(-lgK)与温度的变化关系图,其中正确的曲线是_______ (填"甲"或"乙")。25 ℃时测得该反应在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.5、0.25、0.3,则此时v正_______ v逆(填">""<"或"=")。
(3)某温度下将NO2和Cl2按物质的量之比2∶1 通入恒温恒容密闭容器中发生以下反应2NO(g)+Cl2(g)⇌2NOCl(g),达到平衡时,测得Cl2的平衡转化率为50%,若反应前容器内压强为90 MPa,则该反应条件下的平衡常数为Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
| 热化学方程式 | 平衡常数 | |
| ① | 2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1=+48 kJ·mol-1 | K1 |
| ② | 3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g) △H2=-30 kJ·mol-1 | K2 |
| ③ | 4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 | K3 |
则该温度下,ΔH3=
(2)25℃时,在体积为1L的恒容密闭容器中通入0.8 mol NO和0.4 molCl2发生如下反应2NO(g)+Cl2(g)⇌2NOCl(g)。
①若温度恒定,反应过程中压强(p)随时间(t)的变化如图实线所示,则ΔH
②若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图虚线所示,则改变的条件是

③在5 min时,再充入0.8 mol NO和0.4 molCl2,再次平衡后则NO的转化率
④如图是甲、乙两同学描绘上述反应的平衡常数的负对数值(-lgK)与温度的变化关系图,其中正确的曲线是

(3)某温度下将NO2和Cl2按物质的量之比2∶1 通入恒温恒容密闭容器中发生以下反应2NO(g)+Cl2(g)⇌2NOCl(g),达到平衡时,测得Cl2的平衡转化率为50%,若反应前容器内压强为90 MPa,则该反应条件下的平衡常数为Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


