单选题 较难0.4 引用4 组卷340
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
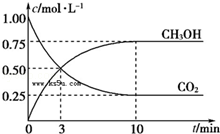
 CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
| A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法 |
| B.3min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C.欲提高H2的平衡转化率只能减小反应容器的体积 |
| D.从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025mol·L﹣1·min﹣1 |
15-16高二上·河北邯郸·阶段练习
类题推荐
I.恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为___________ 。
(2)x=___________ 。
(3)下列各项可作为该反应达到平衡状态的标志是___________ (填字母)。
II.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(4)氢气的转化率=___________ 。
(5)下列措施能使平衡体系中 增大的是___________ (填字母)。
增大的是___________ (填字母)。
III.恒温下,在容积为2L的恒容密闭容器A中通入1molN2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
(6)计算此温度时该反应的K值为___________ 。
(7)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态___________ (填“是”或“否”),此时若没有达平衡,反应向___________ (填“正反应”或“逆反应”)方向进行。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志是___________ (填字母)。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2:1 |
II.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)

(4)氢气的转化率=
(5)下列措施能使平衡体系中
| A.将H2O(g)从体系中分离出去 | B.充入He,使体系压强增大 |
| C.升高温度 | D.再充入1molH2 |
III.恒温下,在容积为2L的恒容密闭容器A中通入1molN2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g)
(6)计算此温度时该反应的K值为
(7)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态
Ⅰ.恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)  xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________ 。
(2)x=__________ 。
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
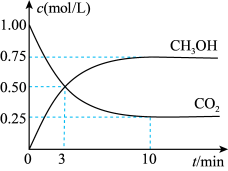
(4)氢气的转化率=________ 。
(5)下列措施能使平衡体系中 增大的是_______(填字母)。
增大的是_______(填字母)。
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态_______ (填“是”或“否"),此时若没有达平衡,反应向_____ (填“正反应”或“逆反应”)方向进行。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2:1 |
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)

(4)氢气的转化率=
(5)下列措施能使平衡体系中
| A.将H2O(g)从体系中分离出去 | B.充入He,使体系压强增大 |
| C.升高温度 | D.再充入1molH2 |
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g)
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态
I.恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)x=_______ 。
(2)下列各项可作为该反应达到平衡状态的标志是_______ (填字母)。
II.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件 下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
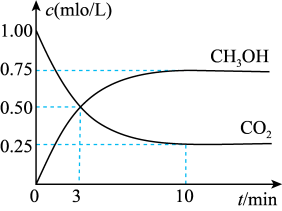
(3)氢气的转化率=_______ 。
(4)下列措施能使平衡体系中 增大的是_______ (填字母)。
增大的是_______ (填字母)。
III.恒温下,在容积为2L的恒容密闭容器A中通入1molN2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
(5)计算此温度时该反应的K值为_______ 。
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态_______ (填“是”或“否”),此时若没有达平衡,反应向_______ (填“正反应”或“逆反应”)方向进行。
(1)x=
(2)下列各项可作为该反应达到平衡状态的标志是_______ (填字母)。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2:1 |
II.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件 下发生反应:CO2(g)+3H2(g)

(3)氢气的转化率=
(4)下列措施能使平衡体系中
| A.将H2O(g)从体系中分离出去 | B.充入He,使体系压强增大 |
| C.升高温度 | D.再充入1molH2 |
III.恒温下,在容积为2L的恒容密闭容器A中通入1molN2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g)
(5)计算此温度时该反应的K值为
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


