解答题-原理综合题 适中0.65 引用1 组卷218
分甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为____________ 。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=____________ 。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________ 。
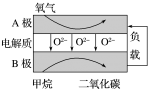
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池____________ 极,电极反应式为________________ 。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______________ (标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________ 。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:

(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为
15-16高二上·湖北黄石·阶段练习
类题推荐
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式_______________________________________ 。

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
请回答下列问题:
①试比较K1、K2的大小,K1_________ K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K为
N2(g)+3H2(g)的平衡常数K为______ 。当测得NH3、N2、H2的浓度分别为3 mol • L−1、2 mol • L−1、1 mol • L−1时,则该反应的v正(N2)____ v逆(N2)(填”>”“=“或”<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol−1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
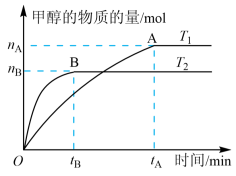
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______ mol·L−1·min−1。
②图示的温度T1______ T2(填写“>”、“<”或“=”)。
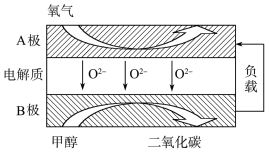
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。
①B电极的反应式为_____________________________________ 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L−1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________ (标准状况)。
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=
②图示的温度T1
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L−1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为
目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH1=860.0kJ•mol-1
②2NO2(g)⇌N2O4(g) ΔH2=66.9kJ•mol-1
写出 CH4催化还原 N2O4(g)生成 N2、H2O(g)和 CO2的热化学方程式_______
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如表:
① 据表中数据分析,t1℃时,该反应在0~20min 的平均反应速率 v(NO)=_______ ,该反应的平衡常数K=_______ 。(常数结果保留 2位小数)
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_______ (填字母代号)。
A.适当缩小容器的体积 B.加入合适的催化剂 C.加入一定量的活性炭 D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO 的浓度之比为5∶3∶3,则达到新平衡时NO 的转化率_______ (填“升高”或“降低”);ΔH_______ 0(填“>”或“<”)。
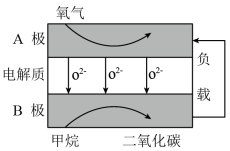
(3)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
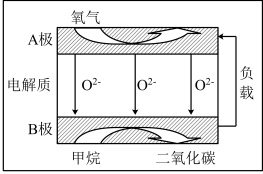
B极上的电极反应式为_______ ;若用该燃料电池做电源,用石墨做电极电解100mL1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为_______ (标况下)。
(1)已知:①CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH1=860.0kJ•mol-1
②2NO2(g)⇌N2O4(g) ΔH2=66.9kJ•mol-1
写出 CH4催化还原 N2O4(g)生成 N2、H2O(g)和 CO2的热化学方程式
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如表:
① 据表中数据分析,t1℃时,该反应在0~20min 的平均反应速率 v(NO)=
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.3 | 0.3 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.3 | 0.3 | 0.36 | 0.36 |
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是
A.适当缩小容器的体积 B.加入合适的催化剂 C.加入一定量的活性炭 D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO 的浓度之比为5∶3∶3,则达到新平衡时NO 的转化率
(3)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

B极上的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网